Données :
Masses molaires :
-
de l’acide salicylique : Mac = 138 g.mol -1
-
de l’anhydride acétique (ou éthanoïque) : Manh = 102
g.mol
-1
-
de l’aspirine : Masp = 180 g.mol -1
Masse volumique de
l’anhydride acétique (ou éthanoïque) : r = 1,08 g.mL -1
Structure
et formulation.
L’histoire
de l’aspirine débute il y a 2000 ans, chez les Sumériens, qui
utilisaient les
feuilles de saule pour soigner la fièvre et les douleurs. Vers 400 ans
avant
J.C., Hippocrate préconise des infusions de feuilles de saule pour
soulager les
douleurs d’accouchement et la fièvre. Mais ce n’est qu’au début du 19e
siècle, grâce aux progrès des techniques d’extraction et d’analyse, que
l’on va
identifier les molécules responsables des propriétés thérapeutiques de
différentes substances naturelles, utilisées jusqu’alors de manière
empirique.
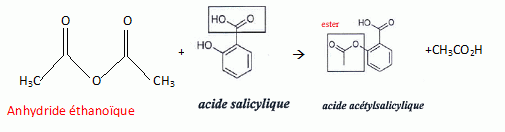
Donner le nom des
groupes caractéristiques
encadrés dans les formules topologiques de :
la
salicine ; l’acide salicylique ; l’acide
acétylsalicylique.
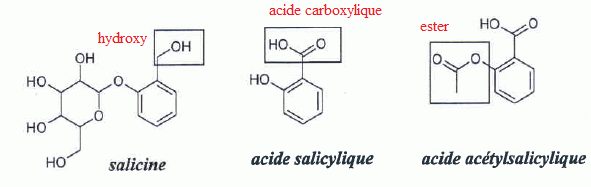
L’acide salicylique
possède une base
conjuguée, l’ion salicylate, mentionné dans le texte.
Donner
sa formule topologique.
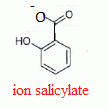
De la même manière, l’acide
acétylsalicylique ou aspirine, possède une base conjuguée,
l’ion acétylsalicylate. Le couple, qu’on notera plus simplement AH/A-
possède un pKa de 3,5.
|
Tracer son diagramme
de prédominance.
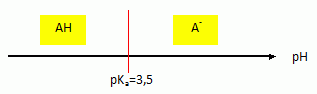
Sachant que le pH de
l’estomac est
voisin de 1, citer l’espèce prédominante de ce couple.
A pH
inférieur au pKa, la forme acide AH du couple acide / base
prédomine.
|
Quand
l’aspirine reste trop longtemps sous cette forme
prédominante dans l’estomac, elle y provoque des lésions gastriques.
C’est
pourquoi on trouve dans le commerce des formulations en poudre, moins
agressives, à base d’acétylsalicylate de sodium, associé à de
l’hydrogénocarbonate de sodium.
La dissolution de la poudre dans un
verre d’eau est
rapide et totale. La solution obtenue contient les ions
acétylsalicylate A–(aq)
et hydrogénocarbonate, de formule HCO3–(aq).
Données : pKa
du couple (CO2,
H2O)(aq) / HCO3–(aq)
=
6,4
Après
absorption, ces ions pénètrent dans l’estomac où le
pH est très acide.
Écrire
l’équation de la réaction se produisant entre les ions
hydrogénocarbonate et
les ions oxonium présents en abondance dans l’estomac.
HCO3–(aq) + H3O+aq =
CO2 aq + 2H2O(l).
Calculer
la
constante d’équilibre K de cette réaction.
K = [CO2 aq , H2O]
/ ([H3O+aq][HCO3–(aq)])
= 1 / Ka = 1/ 10-6,4 =2,5 106.
Au moment
de
l’ingestion du verre d’aspirine, le quotient de réaction initial est
faible par
rapport à K, en
déduire l’influence des ions hydrogénocarbonate sur le pH de
l’estomac.
Q r i
< K, l'équilibre est déplacé dans le sens direct, consommation des
ion H3O+aq contenus dans
l'estomac : le pH de l'estomac augmente.
Synthèse.
Au laboratoire, on peut fabriquer de
l’acide acétylsalicylique (aspirine) à partir de l’acide salicylique et
de
l’anhydride
acétique ( ou éthanoïque) en utilisant un chauffage à reflux.
Lequel de ces deux montages permet de
réaliser un chauffage à reflux ?
Justifier.
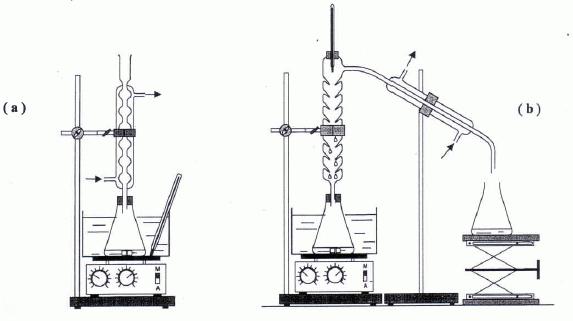
Le
chauffage à reflux (montage a) permet d'accélérer une réaction en
travaillant à température modérée, tout en évitant les pertes de
matière ; les vapeurs se condensent dans le réfrigérant droit et
retombent dans le milieu réactionnel.
Donner la formule
semi-développée de l’anhydride acétique (ou éthanoïque).
Pourquoi utilise-t-on l’anhydride
éthanoïque
plutôt que l’acide acétique pour cette synthèse ?
Écrire l’équation de
la synthèse de
l’aspirine à partir de l’anhydride acétique et de l’acide salicylique.
L'anhydride éthanoïque donne une réaction totale avec l'acide
salicylique ; l'action de l'acide éthanoïque sur l'acide
salicylique conduit à un équilibre chimique.
Dans
un erlenmeyer bien sec, on introduit 10,0 g d’acide
salicylique, 12,0 mL d’anhydride acétique et 0,50 mL
d’acide sulfurique concentré.
À quoi sert l’acide
sulfurique ?
L'acide sulfurique joue le rôle de catalyseur.
Calculer
les quantités de matière des
réactifs introduits. Déterminer le réactif limitant.
nac =mac / Mac = 10,0 / 138=7,25 10-2 mol ;
nanh = r V / Manh
= 1,08*12,0 /102 =0,127 mol.
|
avancement
(mol)
|
anhydride
éthanoïque
|
acide
salicylique
|
aspirine
|
acide
éthanoïque
|
initial
|
0
|
0,127
|
7,25 10-2
|
0
|
0
|
en
cours
|
x
|
0,127-x
|
7,25 10-2 -x |
x
|
x
|
fin
|
xf |
0,127-xf |
7,25 10-2 -xf |
xf |
xf |
Si l'anhydride est en défaut : 0,127-xf
=0 ; xf
=0,127 mol
Si l'acide salicylique est en défaut : 7,25 10-2 -xf =0
; xf =7,25 10-2 mol ;
L'acide salicylique est en défaut, l'anhydride éthanoïque est en excès.
En
déduire la masse théorique mthéo
d’aspirine que l’on peut espérer obtenir.
mthéo
= M asp * xf
= 180*7,25 10-2 =13,04 ~13,0 g.
Après 20 minutes de chauffage,
on sort
l’erlenmeyer du bain-marie. On introduit par le haut du
réfrigérant 20 mL d’eau distillée pour détruire l’anhydride
acétique restant. Quand
l’ébullition a cessé, on ajoute 50 mL
d’eau glacée, puis on place l’erlenmeyer dans un bain d’eau glacée. Les
cristaux d’aspirine apparaissent.
Après cristallisation complète, on filtre sur Büchner. On rince les
cristaux et
on les place à l’étuve pour séchage. La masse expérimentale
d’aspirine obtenue est : mexp =
10,5 g.
Calculer le
rendement de cette synthèse.
mexp
/ mthéo=10,5
/ 13,04 =0,805 ~ 80,5 %.
|
Titrage et
contrôle de la pureté.
Dans une
fiole jaugée de 100 mL, on verse 6,0 g
d’aspirine obtenue expérimentalement. On ajoute 10 mL
d’éthanol pour faciliter la dissolution de l’aspirine, on agite, puis
on
complète avec de l’eau distillée jusqu’au
trait de jauge et on agite à nouveau. On prélève 10,0 mL de
cette solution et
on les dose avec une solution
d’hydroxyde de sodium de concentration en soluté apporté cB
= 0,250
mol.L-1. À l’équivalence, le volume versé
est VbE = 9,3 mL.
Écrire
l’équation de la réaction de titrage de l’aspirine que l’on notera HA.
Couples
acide /base : AH aq / A-aq et H2O(l) / HO-aq.
AH aq + HO-aq = A-aq + H2O(l).
Calculer la
quantité de matière d’aspirine dosée, puis celle contenue dans la fiole
entière.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques :
nasp
= cB VbE
=0,250 *9,3 10-3 = 2,325 10-3
~ 2,3 10-3 mol dans 10 mL
2,3 10-2 mol dans la fiole de 100 mL.
Comparer la
masse d’aspirine dosée à la masse introduite. L’aspirine préparée
est-elle
pure ?
masp = Masp nasp = 180 * 2,325 10-2
=4,19 ~4,2 g.
Cette valeur est inférieure à 6,0 g : l'aspirine obtenue
expérimentalement n'est donc pas pure.
|