Données (à 25 °C)
Aluminium : Z= 13 ; A = 27
Constante d’acidité : Ka (NH4+ / NH3) 10-9,2 soit pKa = 9,2.
Produit ionique de l’eau : Ke = 1,0. 10-14, soit pKe = 14,0
Produit de solubilité de l’hydroxyde d’aluminium, Al(OH)3 : Ks = 1,0 × 10-32.
Constante de dissociation du complexe [Al(OH)4]− : Kd = 1,0 × 10−34.
L’aluminium et les ions aluminium(III).
Donner la composition de l’atome d’aluminium. Préciser sa configuration électronique dans son état fondamental.
Z : numéro atomique, nombre
de charge, nombre d'électrons de l'atome, nombre de
protons du noyau.
13 électrons ; 13 protons et 27-13 = 14 neutrons.
1s2 2s2
2p6 3s23p1
Indiquer la place de l’aluminium dans la classification périodique (ligne et colonne).
ligne n°3 et colonne n°13.
Expliquer pourquoi l’aluminium donne des ions aluminium(III).
En cédant trois
électrons, l'atome donne l'ion Al3+ dont
la dernière couche électronique occupée
est saturée.
Une solution contient des ions aluminium(III) à la concentration CAl égale à 1,00 × 10-2 mol.L-1. On y ajoute progressivement de l’hydroxyde de sodium sans augmentation notable du volume.
Écrire l’équation de la réaction de précipitation qui se produit alors.
Al3+aq + 3HO-aq = Al(OH)3 (s).
Calculer la valeur du pH à partir duquel l’hydroxyde d’aluminium commence à précipiter.
Ks =[Al3+] [HO-]3 = 1,0 × 10-32 avec [Al3+] = 1,00 × 10-2 mol.L-1.
[HO-]3 =1,0 × 10-30 ; [HO-] =1,0 × 10-10 mol L-1 ;
Le produit ionique de l'eau donne : [H3O+] = 10-14 / 1,0 × 10-10 = 1,0 10-4 mol/L.
pH = - log[H3O+] =-log 1,0 10-4 ; pH =4,0.
En milieu suffisamment basique, on observe une disparition du précipité d’hydroxyde d’aluminium.
Expliquer le phénomène en écrivant une équation de réaction. Préciser le nom de l’espèce formée (en nomenclature officielle).
Al(OH)3 (s)+ HO-aq =Al(OH)4-aq (ion tétrahydroxoaluminate (III))
|
Réduction des ions nitrate en ammoniac.
Ecrire la demi équation électronique du couple NO3- / NH3 en milieu basique.
NO3- +6H2O +8e- = NH3 + 9 HO-.
Ecrire la demi équation électronique du couple Al(OH)4- / Al en milieu basique.
Al +4HO- = Al(OH)4- + 3e-.
|
En déduire l'équation de la réaction de l'aluminium avec les ions nitrate.
3 fois { NO3- +6H2O +8e- = NH3 + 9 HO- }
8 fois { Al +4HO- = Al(OH)4- + 3e-}
Addition : 3NO3- +18H2O +24e- +8Al +32HO- = 3NH3 + 27 HO- +8 Al(OH)4- + 24e-
Simplifier : 3NO3- +18H2O +8Al +5HO- = 3NH3 +8 Al(OH)4- .
Transformation des ion ammonium en ammoniac.
Tracer le diagramme de prédominance des espèces du couple NH4+ /NH3.
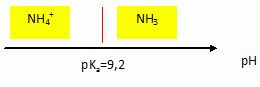
On mélange une solution contenant des ions ammonium avec une solution d’hydroxyde de sodium. Le pH mesuré est égal à 11,0 :
indiquer quelle est alors l’espèce azotée prédominante et écrire l’équation de la réaction qui s’est produite.
A pH supérieur à pKa ( 9,2) la forme NH3 du couple NH4+ aq / NH3 aq prédomine.
Autre couple acide /base : H2O (l) / HO-aq.
Réaction acide base : NH4+ aq + HO-aq = NH3 aq + H2O (l).
Détermination de la teneur totale en azote d'un engrais.
10,0 mL d’une solution d’engrais à 8,00 g.L-1
sont mélangés avec de l’aluminium en excès et de l’hydroxyde de sodium
concentré. On admet que tous les ions (nitrate et ammonium) sont
transformés en ammoniac, qui réagit ensuite totalement avec une solution d’acide sulfurique.
Étude de la solution d’acide sulfurique.
On utilise une solution d’acide sulfurique de concentration 5,00 × 10-2 mol.L-1.
Écrire l’équation de dissolution de l’acide sulfurique, considéré comme un diacide fort.
H2SO4aq +2H2O(l) = 2H3O+ aq+ SO42-aq.
Donner la concentration de la solution d’acide sulfurique en ions H3O+ puis calculer le pH de cette solution.
[H3O+] = 2 x 5,00 × 10-2 = 0,10 mol.L-1.
Vérifier que la quantité de matière d’ions H3O+ présents dans 50,0 mL de la solution d’acide sulfurique est de 5,00 × 10-3 mol.
Quantité de matière (mol) = concentration (mol/L) x volume de la solution (L)
n =0,10 * 50 10-3 =5,0 10-3 mol.
Réaction de l’ammoniac avec l’acide sulfurique.
L’ammoniac produit à partir de l’engrais est dégagé dans 50,0 mL de la solution d’acide sulfurique précédente.
Écrire l’équation de la réaction de l’ammoniac avec les ions H3O+.
Couples acide / base : NH4+ aq / NH3 aq et H3O+aq / H2O(l).
NH3 aq + H3O+aq = NH4+ aq +H2O(l).
Calculer la constante d'équilibre de cette réaction. Conclure.
K = [NH4+ aq ] / ( [H3O+aq][NH3 aq]) =1/Ka = 1/10-9,2 = 109,2.
K est grand : la réaction entre les ions oxonium et l'ammoniac est donc totale.
|
Dosage de l’excès d’acide.
Les ions H3O+ restants, après réaction avec l’ammoniac, sont dosés par une solution
d’hydroxyde de sodium de concentration Cb = 1,00 × 10-1 mol.L-1.
Le volume Veq à l’équivalence est de 30,0 mL.
Ecrire l’équation de la réaction de dosage.
Couples acide / base : H2O(l) / HO- aq et H3O+aq / H2O(l).
H3O+aq +HO- aq =2H2O(l)
Vérifier que la quantité de matière d’ions H3O+ n’ayant pas réagi avec l’ammoniac est de
3,00 × 10-3 mol.
A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques.
nH3O+ = nHO- = Cb Veq = 1,00 × 10-1 *30,0 10-3 = 3,00 10-3 mol.
En déduire la quantité de matière d’ammoniac provenant de l’engrais.
Quantité de matière initiale d'ion oxonium : 5,0 10-3 mol.
Quantité de matière d'ion oxonium ayant réagi avec l'ammoniac :
5,0 10-3 - 3,00 10-3 = 2,00 10-3 mol
NH3 aq + H3O+aq = NH4+ aq +H2O(l).
Donc la quantité de matière d'ammoniac issue de l'engrais est : 2,00 10-3 mol.
Calculer la masse d’azote contenue dans les 10,0 mL de la solution d’engrais utilisée.
Masse (g) = masse molaire de l'azote ( g/mol) * quantité de matière (mol)
m = 14*2,00 10-3 =2,80 10-2 g.
En déduire la composition centésimale de l’engrais en élément azote.
Masse d'engrais dans 10,0 mL : 8,00 / 1000*10 = 8,00 10-2 g.
2,80 10-2 / 8,00 10-2 =0,35 (35 % en masse)
|
|
|
|