On
dispose d'une vieille bouteille de vin de Bordeaux retrouvée au fond
d'une cave. Sur l'étiquette, on peut lire, 12°, année 1968. On se
propose de vérifier ces informations.
Détermination du degré alcoolique du vin.
Le degré alcoolique D d'un vin est le volume d'éthanol exprimé en mL contenu dans 100 mL de vin.
Protocole :
On prélève 10,0 mL de vin étiqueté 12 degrés que l'on traite
par une méthode appropriée afin d'isoler l'éthanol. On complète ensuite
avec de l'eau distillée afin d'obtenir 100 mL d'une solution S1. S1 contient donc tout l'éthanol présent dans les 10,0 mL de vin prélevé.
L'éthanol ( CH3-CH2OH ) est ensuite oxydé en acide acétique ou éthanoïque par une solution de permanganate de potassium.
Dans un erlenmeyer, on mélange un volume V1 = 10,0 mL de la solution S1
et environ 10 mL d'acide sulfurique concentré. On dose cette solution
incolore avec une solution de permanganate de potassium ( K+aq + MnO4-aq) violette de concentration c2 = 8,0 10-2
mol/L. On considère que l'éthanol ne s'évapore pas lors du dosage. On
obtient un changement de couleur de la solution pour un volume de
permanganate de potassium versé égal à V2 = 20,2 mL.
Données : couples oxydant / réducteur mis en jeu :
MnO4- / Mn2+ ( incolore ) ; CH3-COOH ) incolore ) / CH3-CH2OH ( uincolore ).
Masse molaire moléculaire de l'éthanol M0 = 46 g/mol ; masse volumique de l'éthanol r0 = 0,78 g / mL.
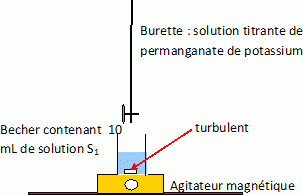
Faire le schéma légéndé du montage de dosage.
|
Avec quoi prélève t-on les 10,0 mL de solution S1 ?Avec quoi prélève t-on les 10 mL d'acide sulfurique concentré ?
Un volume précis, 10,0 mL, est prélevé à l'aide d'une pipette jaugée ( appareil de grande précision ).
Un volume peu précis, 10 mL, peut être prélevé à l'aide d'une éprouvette graduée.
|
L'équation de la réaction totale de dosage est :
4 MnO4- + 5 CH3-CH2OH + 12 H+ = 4 Mn2+ +5 CH3-COOH + 11 H2O.
Justifier l'ajout d'acide sulfurique .
L'ion permanganate joue le rôle d'oxydant puissant en milieu suffisamment acide. L'ion H+ est l'un des réactifs.
Quel changement de couleur observe t-on à l'équivalence ? Justifier.
Dans le becher, avant l'équivalence, l'ion permanganate violet est en défaut et toutes les espèces présentes sont incolores.
Après l'équivalence l'ion permanganate est en excès : la couleur passe de l'incolore au violet.
Donner la relation entre la quantité de matière n1 d'éthanol du prélevement de la solution S1 et la quantité de matière n2 d'ion permanganate versés à l'équivalence.
En déduire que n1 = 1,25 C2 V2. Faire l'application numérique.
4 mol d'ion permanganate réagissent avec 5 mol d'alcool ;
1 mol d'ion permanganate réagit avec 5/4 = 1,25 mol d'alcool ;
n2 mol d'ion permanganate réagit avec n1 = 1,25 n2 mol d'alcool.
De plus n2 = C2 V2 d'où : n1 = 1,25 C2 V2 =1,25 *8,0 10-2 *20,2 10-3 =2,02 10-3 mol dans 10 mL de S1.
Déterminer la quantité de matière n0 d'éthanol contenue dans 100 mL de solution S1. En déduire la masse m0 d'éthanol contenue dans les 10,0 mL de vin.
n0 = 10 n2 =2,02 10-2 mol dans 100 mL de S1 soit dans 10,0 mL de vin.
m0 = n0 * M0 =2,02 10-2 *46 =0,929 ~0,93 g.
Déterminer le volume V0 d'éthanol contenu dans les 10 mL de vin prélevé. En déduire le degré alcoolique D du vin étudié.
V0 = m0 / r0 =0,929 / 0,78 = 1,19 ~1,2 mL d'éthanol dans 10 mL de vin.
Ou bien 11,9 mL d'éthanol pur dans 100 mL de vin. D = 11,9 ~12°, en accord avec l'étiquette.
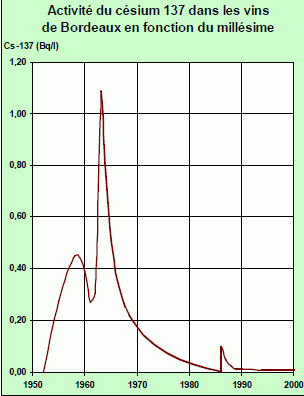
Datation du vin par mesure de l'activité du césium 137 137 Cs.
Une
équipe de scientifiques a montré qu'il était possible de mesurer
l'activité de l'isotope 137 du césium contenu dans une bouteille de
vin, bien qu'il soit présent en faible quantité. ces mesure s'expriment
en mBd / L. Elles ont été réalisées l'année 2000 sur une série de vins
de la région bordelaise d'origines et de millésimes différents. La
courbe obtenue montre que l'activité du césium 137, bien que très
faible, est variable en fonction du millésime.
Données : période du césium 137 : T = 30 ans. 53I ; 54Xe ; 55Cs ; 56Ba ; 57La .
Définir isotopes.
Deux isotopes ont le même numéro atomique Z mais des nombres de neutrons différents.
La loi de décroissance radioactive est A(t) = A0 exp ( -l t), où l représente la constante radioactive. L'activité A se mesure en becquerel ( Bq).
Définir le terme " activité". Que représente A0 ?
L'activité est le nombre de désintégrations par seconde. L'activité initiale est notée A0.
Le césium 137 est un émetteur ß-.
Ecrire l'équation de sa désintégration en précisant les lois utilisées.
13755Cs ---> AZX + 0-1e.
Conservation du nombre de nucléons : 137 = A+0 d'où A = 137.
Conservation de la charge : 55 = Z -1 d'où Z = 56. On identifie l'élément Ba.
13755Cs ---> 13756Ba + 0-1e.
Les mesures sont faîtes sans ouvrir la bouteille. Proposer une justification.
Les grands crus de vieux millésimes ne doivent pas être "détruits" par
l'ouverture de la bouteille. La méthode au césium 137 est non
destructrice puisque la bouteille n'est pas ouverte.
|
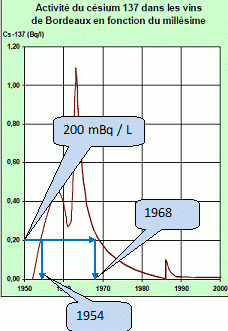
Pour la bouteille de 750 mL en 2000, on mesure une activité de 150 mBq.
Calculer ctte activité en mBq / L et en déduire graphiquement le(s) millésime(s) du vin.
150*1000 / 750 = 200 mBq / L.
Quelle sera l'activité du césium 137 de cette bouteille en 2030 ?
En l'an 2000, l'activité mesurée, notée A0 vaut 200 mBq / L.
Il y a 30 ans entre l'an 2030 et l'an 2000, c'est à dire une durée égale à la période radioactive T.
Au bout d'une durée égale à une période, l'activité est divisée par 2 : A2030 = 100 mBq / L.
|
|
|


