L'acide
chlorhydrique ou solution aqueuse de chlorure d'hydrogène ( H3O+aq
+ Cl- aq) est utilisé comme agent chlorant dans
un certain nombre de réactions chimiques. On souhaite déterminer par
titrage la concentration molaire c0 d'acide
chlorhydrique dans une solution aqueuse concentrée notée S0.
On dispose des informations suivantes : masse molaire MHCl
=36,5 g/mol ; concentration massique : 360 g/mol.

La
solution concentrée S0.
Quelle
précautions faut-il prendre pour manipuler la solution S0
?
La solution étant corrosive, port de blouse, gants et lunette de
protection.
La solution étant trop concentrée, on la dilue 200 fois pour obtenir
une solution notée S. On dispose de la verrerie suivante :
Eprouvettes de 5 mL, 10mL et 25 mL ; pipettes jaugées de 5,0 mL,
10,0 mL et 20,0 mL ; fioles jaugées de 250,0 mL, 500 mL et
1000,0 mL.
Choisir
dans cette liste, en justifiant, la verrerie la plus appropriée pour
effectuer cette dilution.
Le facteur
de dilution est égal à 200. le volume de la fiole jaugée est 200 fois
plus grand que celui de la pipette jaugée.
Pipette jaugée de 5,0 mL et fiole jaugée de 1000,0 mL.
Titrage
de la solution S par conductimétrie.
On titre un volume V = 100 mL de la solution S par une solution aqueuse
d'hydroxyde de sodium ( Na+aq + HO-aq)
de concentration molaire cB = 0,50 mol/L.On
relève la conductance G ( mS) du mélange réactionnel en fonction du
volume vB d'hydroxyde de sodium versé.
| VB(mL) |
0 |
2,0 |
4,0 |
6,0 |
8,0 |
9,0 |
10,0 |
11,0 |
12,0 |
13,0 |
14,0 |
16,0 |
| g(mS) |
9,1 |
8,3 |
7,6 |
6,8 |
6,1 |
5,8 |
5,4 |
6,4 |
7,6 |
8,9 |
10,2 |
12,6 |
|
Faire un
schéma annoté du montage expérimental utilisé pour ce titrage.
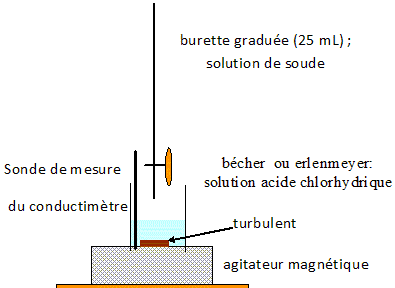 . .
|
Ecrire
l'équation de la réaction mise en jeu lors de ce titrage.
H3O+aq
+HO-aq = 2H2O(l).
Définir
l'équivalence du titrage.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiétriques. Avant l'équivalence, l'acide est en
excès,après l'équivalence, la soude est en excès.
Tracer le
graphe G = f(VB).
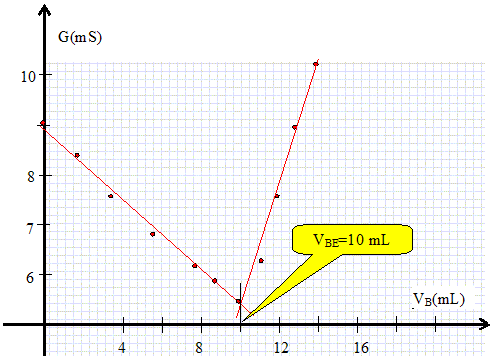
Justifier
qualitativement l'allure du graphe obtenu.
Avant
l'équivalence : les ions oxonium disparaissent, remplacés
par les ions sodium. Oor la conductivité molaire ionique de Na+aq
est très inférieure à celle de l'ion oxonium : la conductance diminue.
Après
l'équivalence : on ajoute des ions sodium et des ions
hydroxyde : la conductance augmente.
Déterminer
la concentration moalire C de l'acide dans la solution S puis C0.
C V = CB VBE ; C = CB
VBE / V =0,50 * 10 / 100 = 0,050 mol/L ; C0
= 200 C = 0,05*200 = 10 mol/L.
En
déduire la concentration massique Cm et la
comparer avec la valeur donnée.
Cm = C0 MHCl =10*36,5
= 365 g/L.
Ecart relatif ( 365-360) / 360 = 0,014 ( 1,4 %). L'écart est faible :
il y a accord entre les deux valeurs.
L'eau oxygénée.
L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène H2O2.
Dismutation du peroxyde d'hydrogène.
le peroxyde d'hydrogène intervient dans deux couples oxydant / réducteur : H2O2 / H2O et O2(g) / H2O2.
Le peroxyde d'hydrogène réagit sur lui même selon une réaction d'oxydoréduction appelée dismutation.
Montrer
à l'aide de l'écriture des demi-équations que l'équation de
la réaction de dismutation du peroxyde d'hydrogène s'écrit :
2 H2O2 = O2(g) + 2H2O.
H2O2 + 2e- +2H+= 2H2O (1) réduction.
H2O2 = O2(g) + 2e- +2H+ (2)oxydation.
Puis ajouter (1) et (2) : 2 H2O2 = O2(g) + 2H2O. Catalyse de la réaction de dismutation.
Lla
dismutation du peroxyde d'hydrogène est spontanée mais très lente
à température ordinaire. Cette réaction peut être catalysée par
les ions fer (III) Fe3+aq présents dans une solution de
chlorure de fer (III) ou par un fil de platine ou encore par la
catalase ( enzyme se trouvant dans le sang ). On considère l'expérience
suivante :
Dans deux bechers, on verse le même volume d'eau
oxygénée. Dans l'un deux on ajoute 1 mL d'une solution diluée de
chlorure de fer (III) et dans le second on ajoute 1 mL de solution
concentrée de chlorure de fer (III).
Dans les deux cas, un
dégagement de dioxygène se produit au sein de la solution mais celui-ci
est beaucoup plus abondant dans le second becher. De plus, on observe
un changement de couleur des solutions : la teinte jaune orangée due
aux ions fer (III) fait place à une teinte brune, puis la couleur jaune
orangée initiale des ions fer (III) réapparaît quand le dégagement
gazeux cesse.
Donner la définition d'un catalyseur.
Un catalyseur augmente la vitesse d'une réaction lente. Il est régénéré en fin de réction et n'apparaît donc pas dans le bilan.
Parmi les catalyseurs cités, indiquer celui que l'on doit utiliser pour que la catalyse soit hétérogène. Expliciter la réponse.
L'eau
oxygénée est un liquide ; le catalyseur solide, le fil de platine
convient. Catalyseur et réactifs ne sont pas dans la même phase.
Indiquer le type de catalyse dont il s'agit dans cette expérience.
Le catalyseur et les réactifs sont dans la même phase liquide : catalyse homogène.
Dans ce type de catalyse, l'efficacité du catalyseur dépend-elle de sa concentration ? Expliciter la réponse.
Le
dégagement gazeux est beaucoup plus important si la solution apportant
le catalyseur est concentrée. L'efficacité du catalyseur dépend donc de
sa concentration.
Indiquer le phénomène observable qui permet de penser que lecatalyseur participe au mécanisme réactionnel.
La teinte jaune orangée des ions fer (III) disparaît en cours de réaction, puis réapparaît lorsque la réaction est terminée.
|
Etude d'une eau oxygénée commerciale.
On réalise par la suite le suivi cinétique de la dismutation du
peroxyde d'hydrogène en présence d'ion fer (III). On détermine ainsi la
concentration molaire du peroxyde d'hydrogène se trouvant dans le
milieu réactionnel pour tracer la courbe qui représente l'évolution de
la concentration en peroxyde d'hydrogène au cours du temps.
Donner l'expression littérale de la vitesse instantanée de disparition du peroxyde d'hydrogène.
v = -d[H2O2]/dt.
Calculer la valeur de la vitesse instantanée à la date t = 5,0 min en explicitant la méthode utilisée.
Tracer
la tangente la courbe à la date t = 5,0 min et calculer son
coefficient directeur. La valeur de la vitesse est égale à la valeur
absolue de ce coefficient.
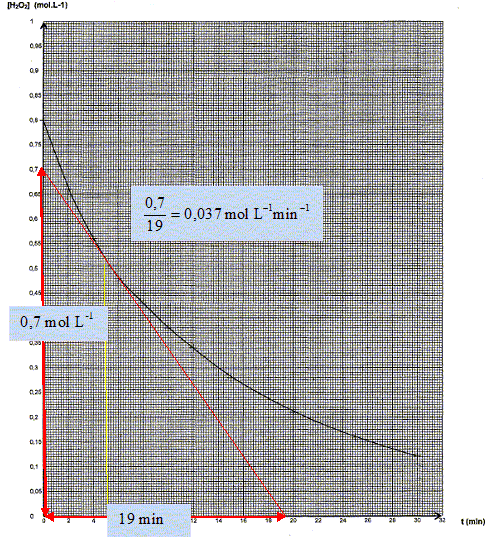
Décrire
l'évolution de la vitesse de disparition du peroxyde d'hydrogène. Quel
facteur cinétique peut être responsable de cette évolution ?
La
concentration en réactif, le peroxyde d'hydrogène, diminue au cours du
temps : la vitesse de disparition du peroxyde d'hydrogène diminue donc
au cours du temps.
Le temps de demi-réaction t½ peut
être défini comme étant la durée nécessaire pur que la
concentration initiale en peroxyde d'hydrogène soit divisée par deux.
Déterminer graphiquement ce temps de demi-réaction.
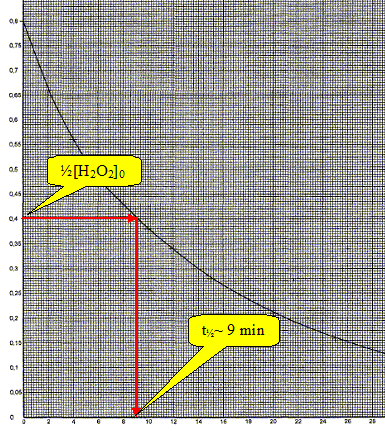
Si la transformation chimique étudiée avait été réalisée à une température plus élevée, comment aurait évolué la valeur du temps de demi-réaction ?
La température est un facteur cinétique. A température plus élevée, la réaction est plus rapie et t½ sera inférieur à 9 min.
|
|
|
|

 .
.

