Le
chlore, élément de numéro atomique 17, a trois isotopes naturels : le
chlore 35 stable ( abondance naturelle : 75,77 % ), le chlore 37 stable
( abondance naturelle : 24,23 % ) et le chlore 36 radioactif ( présent
à l'état de traces ). Le chlore 36 se désintègre spontanément en
formant de l'argon 36 de numéro atomique 18. La demi-vie du chlore 36 (
ou période radioactive ) est t½ = 3,01 105 ans.
Ecrire la
notation symbolique AZX du chlore 36.
3617Cl.
Déterminer la
constitution du noyau de chlore 36.
17
protons et 36-17 = 19 neutrons.
Définir le terme
isotope.
Deux isotopes ont le
même numéro atomique Z mais des nombres de neutrons différents.
Ecrire
l'équation de désintégration du chlore 36 donnant lieu à la formation
de l'argon 36 et préciser les lois de conservation utilisées. De quel
type de désintégration s'agit-il ?
3617Cl
---> 3618Ar
+ AZX.
Conservation de la charge : 17 = 18 + Z d'où Z = -1.
Conservation du nombre de nucléons : 36 = 36 +A d'où A = 0.
3617Cl
---> 3618Ar
+ 0-1e.
( radioactivité de type ß- ).
|
Donner la définition
de la période radioactive d'un élément radioactif.
La période radioactive ou demi-vie t½ est la durée au bout
de laquelle l'activité initiale est divisée par 2.
Démontrer
à l'aide de la loi de décroissance radioactive que la constante
radioactive l est donnée par : l
= ln2 / t½. Calculer sa valeur
en an-1 et en s-1.
Loi de décroissance radioactive : N(t) = N0 exp(-lt)
N(t½) = ½N0 : ½N0=N0 exp(-lt½) ; 0,5 = exp(-lt½) ;
ln 0,5 = -ln 2 = -lt½ ; l =ln2 / t½.
l =ln2 / 3,01 105= 2,30 10-6 an-1.
3,01 105 an = 3,01 105*365*24*3600
=9,49 1012 s.
l =ln2 / 9,49 1012= 7,30 10-14 s-1.
|
L'étude
des isotopes radioactifs apporte des informations concernant la durée
du transit souterrain d'une eau c'est à dire l'âge de la nappe
phréatique. dans les eaux de surface, le chlore 36 est renouvellé par
des réactions nucléaires naturelles et sa teneur peut être supposée
constante, ce qui n'est pas le cas dans les eaux souterraines des
nappes phréatiques où il n'est pas renouvelé. Les études menées sur un
forage de la nappe phréatique du bassin parisien ont montré que l'eau
non renouvelée de la nappe ne contient plus que 38 % de la quantité de
chlore 36 trouvée dans les eaux de surface. A un instant t donné, on
mesure pour un échantillon de cette eau souterraine une activité A(t) =
4,0 103 Bq.
La valeur de
l'activité instanntanée A(t) évolue -t-elle de manière sensible pendant
une durée Dt = 10 min ?
Dt est très inférieure à la
période radioactive du chlore36 : l'activité A(t) ne varie pratiquement
pas durant 10 min.
Calculer le nombre
N(t) de noyaux radioactifs présents dans l'échantillon à l'instant t
donné.
A(t) = l N(t) ; N(t) = A(t) / l = 4,0 103 / 7,30 10-14 =5,48 1016 ~5,5 1016.
Donner la valeur du
rapport N(t) / N0.
"l'eau non renouvelée de la nappe ne contient plus que 38
% de la quantité de chlore 36 trouvée dans les eaux de surface"
N(t) = 0,38 N0 ; N(t) / N0 = 0,38.
Déterminer
l'âge de cette nappe phréatique.
0,38 = exp(-lt) ; ln 0,38 = -lt ; t =- ln 0,38 / l = -ln0,38 / 2,30 10-6
=4,2 105 ans.
Etude d'un électrolyseur.
la plus grande partie de la production de dichlore Cl2 et d'hydroxyde de sodium ( Na+ ; HO-) est assurée par l'électrolyse de solution concentrée de chlorure de sodium ( Na+ ; Cl- ).
Au cours d'une séance de TP, on étudie le principe de cette électrolyse
en traçant la caractéristique d'un électrolyseur contenant une solution
de chlorure de sodium. On relève la tension UAC aux bornes de l'électrolyseur en fonction de l'intensité I du courant qui le traverse.
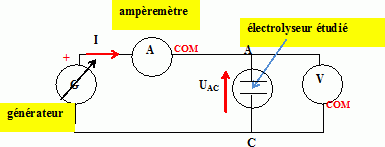
Faire
un schéma du montage électrique mis en oeuvre sachant qu'il comporte un
générateur de tension continue réglable, un interrupteur, des
multimètres et l'électrolyseur.
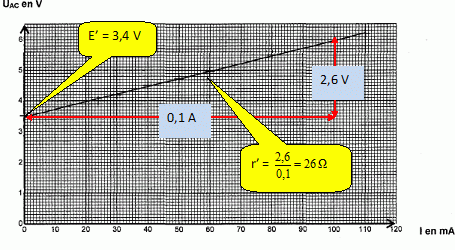
La caractéristique obtenue est la suivante :
Déterminer
la force contre électromotrice E' et la résistance interne r' de l'électrolyseur à l'aide du graphique.
Pendant l'expérience, on laisse fonctionner l'électrolyseur pendant une durée Dt = 1000 s sous une tension UAC = 5,0 V.
Déterminer graphiquement l'intensité du courant.
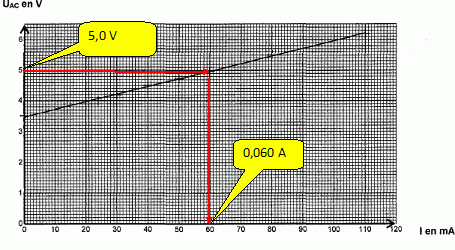
Donner l'expression puis calculer la valeur de l'énergie consommée par l'électrolyseur.
E1 = UAC I Dt = 5,0 *0,060 * 1000 = 300 J = 3,0 102 J.
Donner l'expression puis calculer la valeur de l'énergie convertie en énergie chimique.
E2 = E' I Dt = 3,4 *0,060 * 1000 = 204 J~ 2,0 102 J.
Donner l'expression puis calculer le rendement h de cet électrolyseur.
h = E' / UAC = 3,4 / 5 = 0,68 ( 68 % ).
|
Dans
l'industrie, l'électrolyse d'une solution de chlorure de sodium est
réalisée avec des électrolyseurs dans lesquels la valeur de la tension
entre les électrodes est U = 3,5 V. L'intensité du courant, considérée
comme constante, est I = 5,0 104 A.
Du dichlore est obtenu à l'anode suivant une réaction d'équation : 2 Cl-aq = Cl2(g) + 2e-.
On souhaite calculer la durée nécessaire pour obtenir une tonne de dichlore soit nCl2 = 1,4 104 mol.
Calculer la quantité de matière d'électrons correspondante.
n(e-) = 2 nCl2 = 2,8 104 mol.
En déduire la quantité d'électricité Q correspondante.
Q = n(e-)F = 2,8 104 *9,65 104 = 2,7 109 C.
Calculer en seconde et en heure, la durée Dt nécessaire pour obtenir 1 t de dichlore.
Q = I Dt ; Dt = Q / I = 2,7 109 / 5,0 104 =5,4 104 s
ou 5,4 104 /3600 ~ 15 h.
|
|
|
|


