Un
produit ménager liquide déboucheur d'évier est constitué entre autres
d'hydroxyde de sodium aqueux ( Na+aq + HO-aq).
Sur l'étiquette on trouve les indications suivantes :
pourcentage massique d'hydroxyde de sodium 20 %

Un élève souhaite vérifier l'indication portée par l'étiquette grâce à
un titrage pH-métrique.
Préparation de
la solution à titrer :
Le produit ménager étant très concentré, l'élève effectue une dilution
au 1/20ème afin d'obtenir une solution aqueuse diluée notée
S.
Indiquer
la signification du pictogramme figurant sur le flacon et préciser les
précautions d'emplois correspondantes.
Produit corrosif, port de blouse, lunette de protection et de gants.
Calculer le volume V0
de produit ménager à prélever pour préparer un volume V =
100,0 mL de solution S.
Le facteur de dilution est égal à 20. Il faut donc prélever V0
=V/20 = 100/20 = 5,0 mL de solution mère.
parmi la liste
suivante choisir le matériel adapté pour cette dilution :
- pipette jaugée
de 5,0 mL, 10,0 mL et 20,0 mL ;
- éprouvette graduée de 5 mL, 10 mL, 100 mL et 200 mL ;
- fiole jaugée de
50,0 mL, 100,0 mL
et 200,0 mL.
Titrage
pH-métrique de la solution S.
|
L'élève prélève un volume V =
5,0 mL de la solution S auquel il ajoute environ 20 mL d'eau distillée.
Il titre le mélange obtenu avec une solution d'acide chlorhydrique ( H3O+aq
+ Cl-aq ) de concentration molaire cA = 0,10
mol/L. On appelle VA le volume de la solution d'acide
chlorhydrique progressivement versé.
|
VA(mL)
|
0
|
2,5
|
5,0
|
7,5
|
10
|
11,5
|
12,0
|
13,0
|
13,5
|
14,0
|
pH
|
13,6
|
13,6
|
13,6
|
13,6
|
13,6
|
13,5
|
13,4
|
13,3
|
13,1
|
12,8
|
| VA(mL) |
14,5
|
15,0
|
15,5
|
16,0
|
16,5
|
17,0
|
18,0
|
20,0
|
21,0
|
22,0
|
pH
|
11,6
|
7,1
|
3,0
|
2,5
|
2,0
|
1,6
|
1,3
|
1,1
|
1,1
|
1,0
|
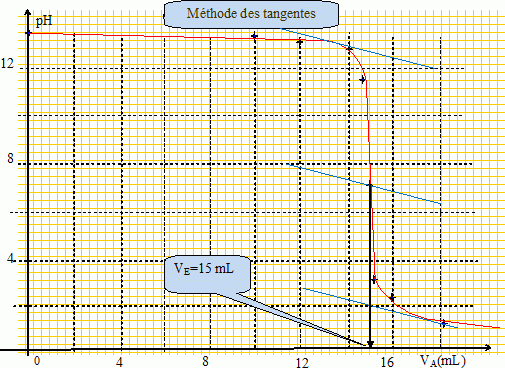
Tracer la courbe pH
= f(VA) et déterminer le volume équivalent en
précisant le nom de la méthode utilisé.
Ecrire l'équation de
la réaction support du titrage.
HO-aq + H3O+aq = 2 H2O(l).
Définir
l'équivalence et donner une relation entre les quantités de matière
utiles.
A l'équivalence les quantités de matière des réactifs sont en
proportions stoechiomètriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'équivalence, l'autre réactif est en excès.
CAVE = V [HO-aq] = V C
A.N : C =CAVE
/ V = 0,10 * 15 / 5 =0,30 mol/L.
Dans le tableau ci-dessous, figurent quelques indicateurs olorés et
leur zone de virage.
indicateur
coloré
|
zone
de virage
|
hélianthine
|
3,1 -
4,4
|
rouge
de phénol
|
6,5 -
8,4
|
phénolphtaléine
|
8,2 -
10
|
Préciser
l'indicateur le plus approprié et justifier.
La zone de virage doit contenir le pH du point équivalent ( 7 dans ce
cas) : le rouge de phénol convient.
Déterminer
la concentration molaire C0 de l'hydroxyde de
sodium dans le produit ménager.
C0 = 20 C = 20*0,30 = 6,0 mol/L.
Calculer
la masse d'hydroxyde de sodium par litre de solution.
Masse molaire de l'hydroxyde de sodium M = 23+1+16 = 40 g/mol.
masse m = C0 M = 6*40 = 240 g/L.
Déterminer
le pourcentage massique d'hydroxyde de sodium dans le produit ménager.
Masse volumique de ce produit ménager r = 1,23 kg L-1.
1L de produit ménager a une masse de 1230 g et contient 240 g
d'hydroxyde de sodium :
240 / 1230 = 0,195 ( 19,5 %).
Ecart relatif : (20-19,5 ) / 20 = 0,025 ( 2,5 %).
Le résultat du calcul est cohérent avec l'indication de l'étiquette.
Cinétique d'une réaction d'oxydoréduction.
On souhaite étudier l'oxydation des ions iodure I-aq par le peroxyde d'hydrogène H2O2aq en milieu acide. Cette réaction est lente.
Les réactifs en présence.
Dans la classification périodique on trouve : 12753I.
Donner le nom et la signification du nombre écrit en bas à gauche du symbole de l'élément.
Numéro atomique ou nombre de charge ; l'atome d'iode compte 53 électrons.
Donner la configuration électronique de l'atome d'iode pris dans son état fondamental.
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5.
Déduire de cette configuration la position de l'iode dans la classification périodique.
17 éectrons externes, donc colonne n° 17 ( l'avant dernière), celle des halogènes.
L'iode est présent dans un grand nombre de composé sous forme d'ion iodure I-.
Proposer une explication à cette tendance à la formation de l'ion iodure.
L'atome d'iode a tendance à compléter sa couche électronique externe,
structure électronique particulièrement stable, en gagnant un électron.
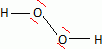
Etablir le schéma de Lewis de la molécule H2O2.
Suivi cinétique de la réaction.
A l'instant t=0, on mélange dans un becher un volume V1 = 100,0 mL d'une solution d'iodure de potassium ( K+aq + I-aq) de concentration molaire c1 = 0,50 mol/L et V2 = 100,0 mL d'une solution de peroxyde d'hydrogène H2O2 de concentration molaire c2 = 5,0 10-2 mol/L. On ajoute un large excès d'acide sulfurique.
On donne les potentiels standards des deux couples oxydant / réducteur suivants :
I2aq / I-aq : E°1 = 0,62 V ; H2O2aq / H2O(l) : E°2 = 1,76 V.
Ecrire la demi-équation électronique pour chacun de ces couples et montrer que l'équation de la réaction est :
2I-aq +H2O2aq + 2H+aq = I2aq + 2H2O(l)
Oxydation de l'ion iodure : 2I-aq = I2aq + 2e- ;
Réduction du peroxyde d'hydrogène : H2O2aq + 2H+aq + 2e- = 2H2O(l) ; puis additionner.
Calculer les quantités de matière d'ions iodure n1 et de peroxyde d'hydrogène n2 apportées dans le mélange initial. Déterminer le réactif limitant.
n1 = V1c1 = 0,100 *0,50 = 5,0 10-2 mol.
n2 = V2c2 = 0,100 *0,050 = 5,0 10-3 mol.
5,0 10-3 mol de peroxyde d'hydrogène oxyde 2*5,0 10-3 = 1,0 10-2 mol d'ion iodure. Il reste donc 4,0 10-2 mol d'ion iodure. Le peroxyde d'hydrogène est en défaut ( réactif limitant ).
|
A
l'instant t = 2,5 min, on prélève un volume V = 10,0 mL du mélange et
l'on dose la quantité de diiode formé. On répète cette opération
toutes les 2 minutes 30 secondes. La courbe donnant l'évolution de la
concentration molaire du diiode en fonction du temps est fournie.
Calculer la valeur de la vitesse de formation du diiode à l'instant t= 5 min.
On détermine le coefficient directeur de la tangente à la courbe à la date t = 5 min.
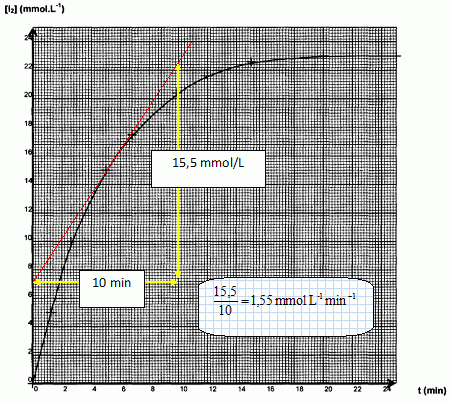
En déduire la valeur de la vitesse de disparition du peroxyde d'hydrogène à l'instant t = 5 min.
2I-aq +H2O2aq + 2H+aq = I2aq + 2H2O(l)
Au
regard des coefficients stoechiométriques, la vitesse de disparition du
peroxyde d'hydrogène est égale à la vitesse de formation du
diiode.
Proposer une méthode qui permettrait d'augmenter la vitesse de la réaction.
Travailler à température plus élevée.
|
|



