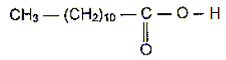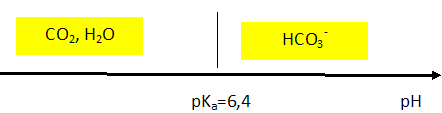A
l'hopital, un patient est soigné pour une acidose métabolique. Cette
maladie fait chuter le pH du sang en dessous de 7,38. Pour faire
remonter le pH, on peut lui administrer par perfusion intraveineuse une
solution d'hydrogénocarbonate de sodium..
Ester, fabrication d'un savon :
L'infirmière
se lave soigneusement les mains avec du savon pour éliminer les
bactéries. On s'intéresse à la synthèse du savon à partir d'un ester A
de formule semi-développée plane :
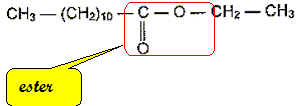
Recopier la formule et entourer le groupe caractéristique présent.
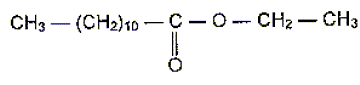
Pour préparer cet ester on utilise un acide carboxylique et un alcool de formule semi-développée CH3-CH2OH.
Nommer cet alcool .
alcool éthylique ou éthanol.
Ecrire la formule semi-développée de l'acide utilisé.
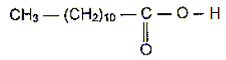
|
Synthèse du savon à partir de l'ester.
La fabrication du savon se fait en trois étapes :
- Dans un ballon on dispose une masse m de l'ester A et une solution aqueuse de soude ( hydroxyde de sodium Na+ + HO-) en excès. On chauffe grâce à un montage à reflux pendant environ 20 minutes.
- On laisse refroidir puis on verse le mélange dans un grand becher contenant une solution saturée de chlorure de sodium.
- On filtre et on récupère le savon.
|
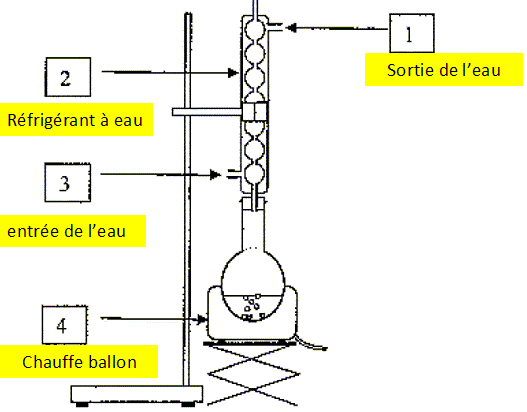
A l'aide du
schéma du montage de chauffage à reflux, associer un chiffre à chacun
des termes : entrée d'eau, sortie de l'eau, chauffe ballon, réfrigérant
à eau.
Compléter l'équation de la réaction, appelée réaction de saponification de l'ester.
Ester A + Na+ aq + HO-aq = CH3-(CH2)10-COO- + Na+ aq +CH3-CH2OH.
Cette réaction est-elle totale ou limitée ?
Cette réaction est totale.
Le savon,obtenu en solution aqueuse, contient l'ion CH3-(CH2)10-COO-.
Recopier la formule de cet ion et indiquer les pôles hydrophile et hydrophobe.
La longue chaîne carbonée est la partie hydrophobe : CH3-(CH2)10-
Le groupe -COO-.est hydrophile..
Dans cet hopital l'eau est dure. Que peut-on dire de l'efficacité de ce savon ?
Une eau dure contient beaucoup d'ion calcium et magnésium. Or les carboxylates de calcium et de magnésium sont insolubles.
Un savon est beaucoup moins efficace dans une eau dure.
Acide et base dans les milieux biologiques.
Sur
la poche à perfuser on peut lire : : bicarbonate de sodium 1,4 % ;
bicarbonate de sodium 1,4 g ; eau : 100 mL ; sodium : 0,16 mol/L ;
bicarbonate : 0,166 mol/L ; pH : 7,0 - 8,5.
On souhaite doser la
solution contenue dans la poche à perfuser pour vérifier sa
concentration. Un des ions présents dans cette solution est l'ion
hydrogénocarbonate HCO3-. Il est nommer par le
laboratire qui vend la solution à perfuser, ion bicarbonate. Pour
vérifier les indications de l'étiquette, cet ion va être dosé par
l'acide chlorhydrique ( H3O+ + Cl-).
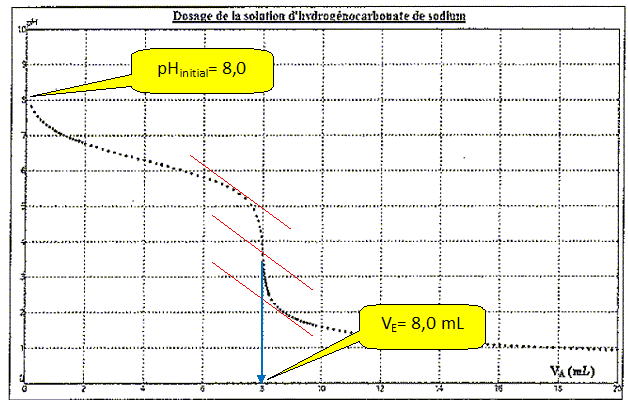
On prélève V = 20,0 mL de solution à perfuser et on utilise une solution d'acide chlorhydrique de concentration cA = 0,40 mol/L. On effectue le dosage par pHmétrie et on obtient la courbe suivante :
Déterminer graphiquement le volume VE versé à l'équivalence et le pH initial.
Pour
procéder à ce dosage, on utilise le matériel suivant : une pipette
jaugée, un becher, un pH-mètre, une burette, un agitateur magnétique
A quoi sert la pipette jaugée ? Quelle est la solution à introduire initialement dans le becher ?
La
pipette jaugée permet de prélever V = 20,0 mL de solution de
bicarbonate. ; ce prélevement est placé dans un erlenmeyer ou dans un
becher.
La solution d'acide chlorhydrique est versée initialement dans un becher afin de remplir la burette graduée.
Tracer le diagramme de prédominance du couple CO2, H2O / HCO3- sachant que le pKa de ce couple vaut 6,4. En déduire l'espèce dominante à pH = 2.
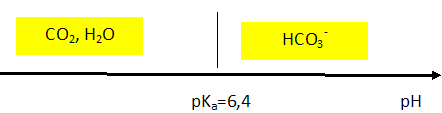
A pH inférieur à pKa, la forme acide CO2, H2O du couple acide / base prédomine.
Dans le couple H3O+ / H2O, l'eau est-elle considérée comme un acide ou comme un base ? Définir le terme choisi.
L'eau
est écrite en deuxième position dans le couple acide / base, c'est une
base : une base est une espèce, ion ou molécule susceptible de gagner
un proton H+.
On se propose de vérifier la valeur indiquée par le fabricant. L'équation du dosage de l'ion hydrogénocarbonate HCO3- par l'ion oxonium H3O+ est :
HCO3- + H3O+ = CO2, H2O + H2O.
Donner la relation entre la quantité de matière initiale nhydro d'ion hydrogénocarbonate et la quantité de matière nA d'acide versé à l'équivalence.
A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques.
nA =nhydro .
Montrer que nhydro = 3,2 10-3 mol.
nhydro = nA = VE cA = 8,0 10-3 *0,40 =3,2 10-3 mol.
En déduire la concentration des ions hydrogénocarbonate dans la solution et conclure.
nhydro = C V = 3,2 10-3 ; C = 3,2 10-3/ 20,0 10-3 =0,16 mol/L ( en accord avec l'indication portée sur l'étiquette ).
|
Ecoulement des liquides.
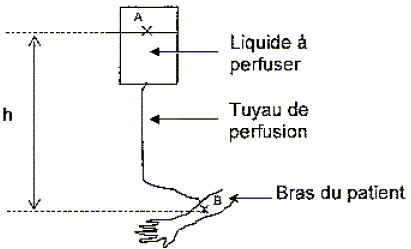
la
poche contenant la solution à perfuser est placée à une hauteur h
au-dessus de bras du malade. Le niveau du liquide à perfuser est
horizontal et à la pression atmosphérique patm = 101300 Pa.
On considère un point A à la surface du liquide. On a donc patm = pA.
Un cathéter est placé dans le bras du patient, en un point B où la pression vaut pB = 111300 Pa.
La poche contient un volume V = 100 mL de solution à perfuser de masse volumique r = 1000 SI.
Indiquer l'unité de la masse volumique dans le système international.
kg m-3.
Calculer la différence de pression Dp entre les points A et B et en déduire h.
Dp = pB-pA = 111300-101300 =10 000 Pa.
Dp = pB-pA = r g h = 1000*9,81 h = 9810 h ;
h = 10 000 / 9810 = 1,02 ~1,0 m.
La solution à perfuser a un débit D constant égal à 1,4 10-8 m3 s-1.
Donner la relation entre le débit, le volume V et le temps d'écoulement Dt en précisant les unités..
D = V / Dt avec V en m3 et Dt en seconde.
Calculer Dt si V = 100 mL ( 1 mL = 10-6 m3).
Dt = V / D = 10-4 / 1,4 10-8 =7145 s ~ 2 heures.
La résistance hydraulique entraîne une perte de charge dans le tuyau où
s'écoule le liquide à perfuser. Pour étudier expérimentalement
l'influence de différents facteurs sur la résistance hydraulique, on
utilise le matériel ci-dessous :
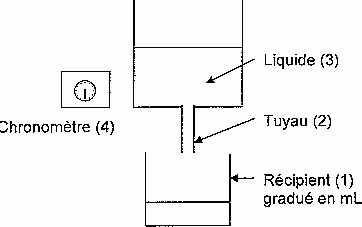
Pourquoi utilise t-on un chronomètre et un récipient gradué ?
Pour déterminer un débit il faut connaître un volume ( d'où le
récipient gradué ) et le temps d'écoulement du liquide ( d'où le
chronomètre ).
On souhaite déterminer expérimentalement l'influence de la nature du liquide sur la résistance hydraulique.
Nommer l'élément du montage à modifier et préciser le numéro correspondant.
On doit utiliser des liquides ( élément n°3) de viscosité différente.
Citer un facteur, autre que la nature du liquide ayant une influence sur la résistance hydraulique.
Le tuyau : sa forme, sa section, son état de surface.
Calculer la section du tuyau si la vitesse moyenne est v = 1,0 10-2 m/s.
D = S v d'où S = D / v = 1,4 10-8 / 1,0 10-2 =1,4 10-6 m2 = 1 mm2.
|