|
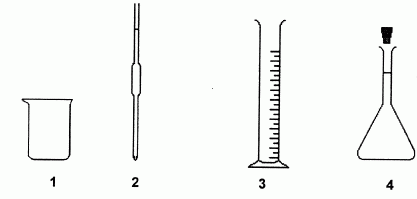
On dispose de la verrerie ci-dessous, de contenance adaptée.
Choisir et nommer la verrerie nécessaire au prélèvement du volume Va = 10,0 mL de solution à doser. préciser le numéro du schéma correspondant.
Pipette jaugée (n° 2 ).
|
Le schéma du dispositif de dosage est donné ainsi qu'une vue agrandie de la partie supérieure de la burette graduée.
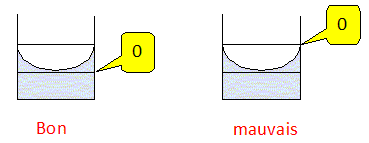
Le réglage initial de la burette a-t-il été correctement effectué ? Expliciter la réponse.
Le réglage est mauvais, la partie inférieure du ménisque doit affleuré le trait du zéro.
Le réglage de la burette étant correctement effectué, on réalise la courbe de suivi de pH en fonction du volume Vb de solution d'hydroxyde de sodium versé. On obtient la courbe pH = f(Vb).
Faire apparaître la méthode graphique utilisée afin de déterminer le volume VbE versé à l'équivalence.
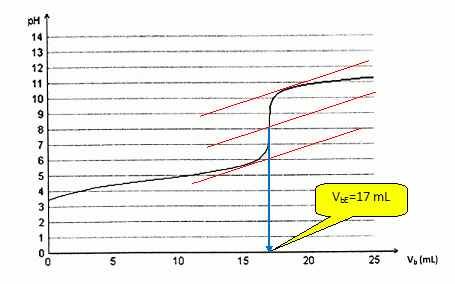
Donner la relation entre la quantité de matière na d'acide éthanoïque dosé et la quantité de matière nbE d'ions hydroxyde introduite à l'équivalence.
A l'équivalence, les quantités de matière des réactifs sont en proportions stoechiométriques. na = nbE
Le volume versé àl'équivalence est VbE = 17,0 mL.
Déterminer la concentratin Ca de l'acide éthanoïque dans la solution diluée.
Ca Va = Cb VbE ; Ca = Cb VbE / Va =0,10*17,0 / 10,0 = 0,17 mol/L.
Quelle
information donnée dans la description du dosage permet
d'affirmer que la concentration d'acide éthanoïque dans le produit
d'entretien est égale à C = 1,7 mol/L.
" On dilue d'abord ce produit 10 fois".
Calculer
la masse molaire de l'acide éthanoïque, puis la masse d'acide
éthanoïque, notée m présente dans 1 L de produit d'entretien.
M = 2*12+4+2*16 = 60 g/mol.
m = n M = 1,7 *60 = 102 g/L.
Le dosage a-t-il permis de trouver une valeur proche de celle indiquée sur l'étiquette ?
Oui : l'étiquette indique 100 g /L ( écart de 2 %).
Savon à base d'huile d'olive.
L'huile
d'olive contient un corps gras ( triglycéride ) : l'oléine. La formule
semi-développée de l'oléine est représentée.
Entourer et nommer le(s) groupe(s) caractéristique(s) présent(s) dans cette molécule.
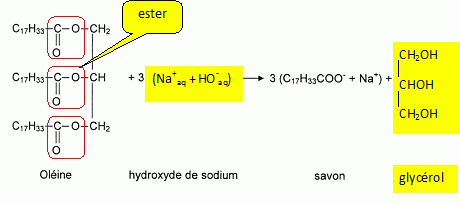
L'oléine peut être obtenue par réaction entre l'acide oléïque et le glycérol. L'acide oléïque est un acide gras insaturé.
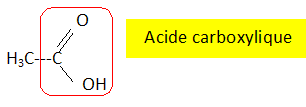
Parmi les trois formules suivantes d'acide carboxylique, reconnaître et entourer celle de l'acide oléïque. Expliquer brièvement à l'aide d'une phrase.
CH3-(CH2)14 - est saturée ( 31 hydrogènes pour 15 carbones ) ; C17H35- est saturée ( 35 hydrogènes pour 17 carbones ).
L'oléine réagit avec l'hydroxyde de sodium pour former un savon appelé oléate de sodium et un autre produit.
Compléter les formules semi-développées et les noms dans l'équation de la réaction donnée.
Voir schéma ci-dessus.
Nommer cette réaction.
La saponification d'un ester.
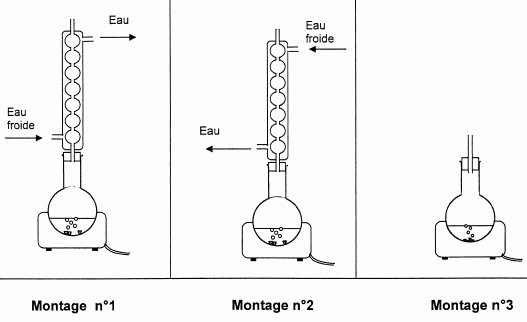
Lors de la fabrication d'un savon on utilise un montage de chauffage à reflux.
Parmi les montages proposés ci-dessous, lequel doit-on utiliser ?
Montage n°1.
On fait réagir 10 moles d'oléine avec un excès d'hydroxyde de sodium.
Déterminer la quantité de matière de savon que l'on peut espérer obtenir.
Une mole d'oléine donne 3 moles de savon ; 10 moles d'oléine donnent 30 moles de savon.
|
Scintigraphie.
La
scintigraphie permet d'examiner l'état d'un organe à partir d'images
obtenues après injection d'une faible quantité d'une substance
radioactive. l'iode 123 radioactif peut être utilisé dans le cas de la
thyroïde. Par un dispositif adapté, on étudie la radioactivité de
l'iode injecté.
Déterminer la composition du noyau d'iode 123 : 12353I.
53 protons et 123-53 = 70 neutrons.
Compléter l'équation de désintégration de l'iode 123 et préciser le type de radioactivité.
12353I ---> 12352Te + 01e.
Emission d'un positon, donc radioactivité de type ß+.
Le noyau de tellure est émis dans un état excité. Un rayonnement g est émis lors de la désexcitation du noyau. Ce sont ces photons qui permettent d'obtenir une image grâce à une g-caméra.
L'énergie de l'un de ces photons est E1 = 2,50 10-13 SI.
Donner le symbole et le nom de l'unité d'énergie dans le système internationale d'unités.
L'énergie s'exprime en joule ( J).
Calculer la fréquence v1 du photon d'énergie E1.
v1 = E1 / h =2,50 10-13 / 6,62 10-34 = 3,78 1020 Hz.
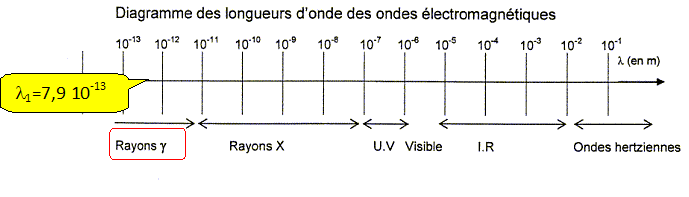
La longueur d'onde de ce photon est l1 =7,94 10-13 m.
A l'aide du diagramme des ondes électromagnétques donné, montrer que cette valeur est en accord avec le type de photons émis.
L'imagerie médicale utilise également des rayons X.
Des rayons X ou des gamma g, lesquels sont les plus énergétiques ?
Les rayons g, de longueurs d'onde inférieures à celles des rayons X, sont les plus énergétiques.
Précautions à prendre après l'examen.
Une
des protections contre l'irradiation est l'éloignement de la source
radioactive. par conséquent la patiente doit rester éloignée des jeunes
enfants après son examen car elle se comporte comme une source
radioactive pendant une durée voisine d'un jour. la faible quantité de
radioactivité qui subsiste après l'examen s'élimine naturellement et
rapidement.
Citer un des moyens ( autre que l'éloignement ) utilisé par le personnel médical pour se protéger des rayonnements radioactifs.
Des plaques de plomb de quelques cm d'épaisseur sont placées entre la source radioactive et le personnel méédical.
La période ( ou demi-vie ) radioactive de l'iode 123 est de 13,3 heures.
Définir la période radioactive.
La demi-vie, notée t½, est la durée au bout de laquelle l'activité initiale est divisée par deux.
Au bout de 26,6 heures, soit un peu plus d'une journée après l'examen, l'activité initiale A0 de l'iode sera-t-elle divisée par 2, par 4 ou par 8 ? Expliciter la réponse.
Au bout de 13,3 heuures, l'activité initiale vaut : A1 = ½A0.
Au bout de deux demi-vie, soit 26,6 heures, l'activitée vaut : A2 = ½A1 = 0,25 A0.
L'activité initiale est divisée par 4 aut bout de 26,6 heures.
Dans
le cadre de l'utilisation en médecine nucléaire, on admet qu'au bout
d'un temps égal à environ 20 fois la période du radioélément,
l'échantillon qui le contient est considéré comme inactif.
Au bout d'une journée d'éloignement la patiente n'est plus dangereuse, cependant est-elle toujours radioactive ?
Au
bout d'une journée ( soit environ 2 périodes), l'activité résiduelle de
l'iode 123 est égale 25 % de l'activité initiale : l'échantillon est
encore actif et la personne est donc encore radioactive.
|