On étudie
l'évolution temporelle de la réaction d'oxydation du propan-2-ol par
les ions permanganate. Cette réaction aboutit lentement à la formation
de propanone. L'équation (1) associée à la réaction s'écrit :
5 C3H8O(l) + 2MnO4-aq + 8H+aq
= 5 C3H6O(l)
+ 2Mn2+aq + 8H2O(l) (1).
La transformation associée sera considérée comme totale.
Préparation du mélange réactionnel.
On introduit dans un erlenmeyer 50,0 mL d'une solution de permanganate
de potassium de concentration c0 = 0,20 mol/L et 55,0 mL
d'une solution d'acide sulfurique en excès.
On place l'erlenmeyer sous agitation magnétique.
A l'instant t=0, on ajoute 1,0 mL de propan-2-ol au contenu de
l'erlenmeyer.
Etude de l'évolution de
l'avancement.
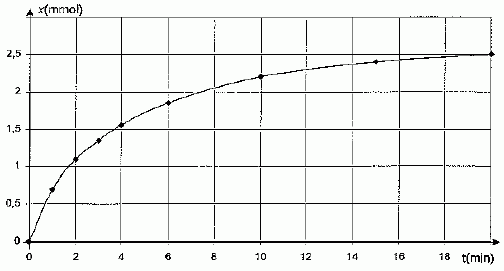
Afin de représenter la courbe qui traduit l'évolution de l'avancement x
de la réaction en fonction du temps, on prélève à l'instant t, un
volume V = 10,0 mL du mélange réactionnel que l'on verse dans un becher
contenant 40 mL d'eau glacée.
On titre ensuite les ions permanganate contenus dans le becher par une
solution de sulfate de fer (II) de concentration connue c' = 0,50
mol/L. Le volume équivalent Véq obtenu permet ensuite
d'en déduire l'avancement x de la réaction d'oxydation de l'alcool à
l'instant t.
On renouvelle l'opération à différentes dates et on trace la
courbe suivante :
On donne pour le
propan-2-ol : M = 60,0 g/mol ; masse volumique r = 0,785 g /mL.
Couples oxydant / réducteur : Fe3+aq / Fe2+ aq ; MnO4-aq / Mn2+ aq ; C3H6O(l)
/ C3H8O(l).
L'ion permanganate est violet ; l'ion manganèse (II) Mn2+ aq est incolore.
Etude de la réaction support du
titrage ( réaction 2).
Pourquoi
a t-on introduit chaque prélevement dans 40 mL d'eau glacée
?
On réalise un blocage cinétique : la transformation (1) n'évolue plus,
ce qui laisse le temps de réaliser le titrage ( réaction 2).
Montrer
ue la réaction support du titrage est :
MnO4-aq
+ 8H+aq + 5Fe2+ aq =Mn2+aq + 5Fe3+aq +4H2O(l)
(2).
réduction
: MnO4-aq
+ 8H+aq + 5e- = Mn2+aq +4H2O(l)
oxydation : 5Fe2+ aq =
5Fe3+aq + 5e-.
ajouter : MnO4-aq
+ 8H+aq + 5e- + 5Fe2+ aq = Mn2+aq +4H2O(l) 5Fe3+aq + 5e-.
simplifier : MnO4-aq
+ 8H+aq + 5Fe2+ aq =Mn2+aq + 5Fe3+aq +4H2O(l)
Définir équivalence
du titrage. Comment la repère t-on ?
A l'équivalence les réactifs sont introduits en proportions
stoechiométriques.
Avant l'équivalence, dans le becher, l'ion permanganate est en excès :
la solution a une teinte violette.
Après l'équivalence, l'autre réactif, l'ion fer(II) est en excès : la
solution est incolore.
On repère l'équivalence par le changement de teinte : violet
--> incolore.
Exprimer
la quantité de matière d'ion permanganate nprél (MnO4-) dans le
prélevement à l'instant t en fonction de c' et Véq.
D'après
les nombres stoechiométriques de la réaction (2), à l'équivalence
: n(Fe2+) = 5 nprél (MnO4-)
de plus : n(Fe2+)
=c'Véq d'où nprél (MnO4-) = c'Véq /5.
Etude de
la réaction principale ( réaction
1).
On peut
considérer que la quantité n d'ions permanganate à l'instant t
dans le mélange réactionnel est n = 10 nprél (MnO4-).
Exprimer puis calculer les
quantités initiales d'ions permanganate et de propan-2-ol dans le
mélange réactionnel.
"V0 =50,0 mL d'une solution de permanganate de potassium de
concentration c0 = 0,20 mol/L"
n0(MnO4-)
=V0 c0 = 0,050 * 0,20 = 1,0 10-2
mol.
"V'0=1,0 mL de propan-2-ol ; M = 60,0 g/mol ; masse volumique r = 0,785 g /mL.
n0(alcool)
=masse / masse molaire avec masse(g) = volume(mL) * masse volumique (
g/mL)
n0(alcool)
=V'0 r /M = 1,0 *0,785 / 60 = 1,31 10-2
~1,3 10-2
mol.
Compléter
avec les expressions littérales le tableau d'avancement de la
réaction 1.
|
avancement
(mol)
|
5 C3H8O(l) |
+ 2MnO4-aq
|
+ 8H+aq |
= 5 C3H6O(l) |
+ 2Mn2+aq
|
+ 8H2O(l)
(1) |
initial
|
0
|
n1
|
n0
|
excès
|
0
|
0
|
solvant
|
en
cours
|
x
|
n1-5x
|
n0-2x
|
excès |
5x
|
2x
|
solvant |
fin
|
xmax
|
n1-5xmax |
n0-2xmax |
excès |
5xmax |
2xmax |
solvant |
Calculer
l'avancement maximal. Quel est le réactif limitant ?
Si C3H8O
est en
défaut n1-5xmax= 0 ; xmax=n1/5
=1,31 10-2 /
5 =2,6 10-3.
Si MnO4-
est
en défaut : n0-2xmax = 0 ; xmax
=n0/2
=1,0 10-2 /
2 =5 10-3.
On retient la plus petite valeur : xmax=2,6 10-3mol ;
l'alcool est en défaut.
Exprimer
l'avancement x de la réaction en fonction de n0(MnO4-),
c' et Véq.
"la quantité n d'ions permanganate à l'instant t dans le mélange
réactionnel est n = 10 nprél (MnO4-)" = 10
c'Véq /5 = 2
c'Véq.
n0(MnO4-)-2x
= 2
c'Véq ; 2x = n0(MnO4-)- 2
c'Véq ;
x= ½n0(MnO4-)-
c'Véq.
|
Temps de
demi-réaction.
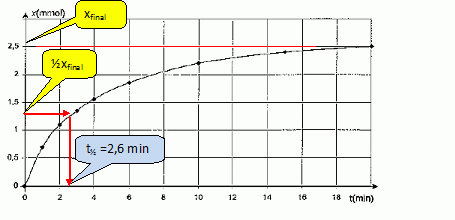
Définir
à l'aide d'une phrase le temps de demi-réaction.
Le temps de demi-réaction est la durée au bout de laquelle l'avancement
est égal à la moitié de l'avancement final.
Déterminer
graphiquement t½.
"La transformation
associée sera considérée comme totale" : l'avancement final est égal à
l'avncement maximal.
|