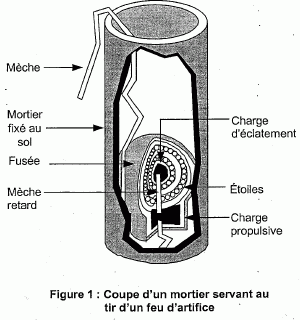
Dans cet exercice,
on s'interesse à la mécanique d'un feu d'artifice puis à I'émission
lumineuse liée à I'élément cuivre et ensuite au dosage de I'élément
cuivre dans une pièce de monnaie.
Mécanique
du feu d'artifice.
La pyrotechnie, du grec « pyros » feu et « teckhne » savoir-faire, est
la technique des feux d'artifice.
Elle fut inventée par les chinois, il y a plus de mi1le ans et
introduite en Occident grâce à Marco Polo au XIème siècle.
La fusée pyrotechnique sphérique est, sans con teste, Ie projectile Ie
plus employé
par les techniciens lors des feux d'artifices modernes. Elle est tirée
depuis un mortier fixe au sol et est expulsée à grande vitesse par les
gaz produits par I'explosion de la charge propulsive.
A I'apogée, une charge d'éclatement provoque I'explosion de la fusée et
disperse les garnitures pyrotechniques qu'on appelle « étoiles ».
L'etude des mouvements des centres d'inertie des différents projectiles
est réalisée dans Ie référentiel terrestre supposé galiléen.
Etude théorique
de la phase ascensionnelle de la fusée pyrotechnique.
Une fusée pyrotechnique de masse M= 400 g est tirée verticalement avec
une vitesse initiale de valeur v0 = 50, 0 m/s.
On étudie Ie mouvement de son centre d'inertie G dans un repère
vertical (0, J ) orienté vers le haut.
On choisit l'instant t0 = 0 s lorsque Ie centre d'inertie G
est confondu avec I'origine du repère O.
On néglige Ie mouvement de rotation de la fusée pyrotechnique sur
elle-même ainsi que les actions mécaniques liées à I'air (poussée
d'Archimède et force de frottements). Lors du tir, la vitesse du vent
est considérée comme étant nulle et on admet que la fusée pyrotechnique
ne subit pas de perte de· masse lors de son mouvement ascendant.
Un logiciel de simulation permet d'obtenir Ie
graphe de I'évolution temporelle de I'énergie cinétique Ec, de I'énergie potentielle de pesanteur Ep et de
I'énergie mécanique totale Em de la fusée lors de son
mouvement ascendant. On prend I'origine de l'énergie potentielle de
pesanteur au point O.
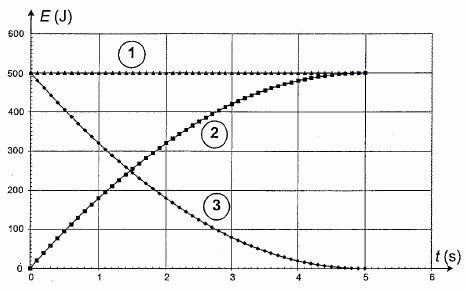
Identifier chacune
des courbes.
Courbe 1 : l'énergie mécanique est la somme de l'énergie
potentielle et de l'énergie cinétique.
Courbe 2 : l'énergie potentielle initiale est nulle, puis est croissante
Courbe 3 : la vitesse, donc l'énergie cinétique initiale est maximale,
puis décroît.
En
s'aidant du graphique, déterminer l'instant tA auquel la fusée
pyrotechnique atteint son altitude maximale YA (apogée). Justifier.
A l'apogée, l'énergie potentielle est maximale, égale à l'énergie
mécanique, tandis que la vitesse, donc l'énergie cinétique est nulle.
On lit tA ~ 4,8 s.
Donner
l'expression de l'énergie mécanique aux instants t0 et tA.
Initialement l'énergie mécanique est sous forme cinétique : Em(0)
= ½mv02.
A l'apogée l'énergie mécanique est sous forme potentielle de pesanteur
: Em(tA) = mg YA.
En
déduire que l'expression de la coordonnée YA de l'apogée
atteinte par la fusée pyrotechnique s'exprime par la relation ci-dessous
:
YA =v02/(2g)
"On néglige "
les actions mécaniques liées à I'air (poussée d'Archimède et force de
frottements)".
l'énergie mécanique se conserve : Em(0) =Em(tA)
½mv02=mg YA ; ½v02=g
YA ; YA =v02/(2g).
Calculer
la valeur de l'altitude de l'apogée sachant que l'accélération de la
pesanteur vaut g = 9,8 m.s -2.
YA =502/(2*9,8)=127,6 m ~1,3 102 m.
En réalité I'apogée vaut 122 m, interpréter le fait
que cette valeur est différente de celle calculée.
Dans la réalité , il faut prendre en compte les actions
mécaniques liées à I'air (poussée d'Archimède et force de
frottements) ainsi que la rotation de la fusée.
Dispersion des
« étoiles ».
Dans Ie repère (0, i, j) de la figure, on étudie le mouvement d'une «
étoile» produite lors de l'explosion de la fusée à l'apogée de sa
trajectoire. Cette « étoile» est projetée à partir du point A à
une altitude YA = 122 m. Le vecteur vitesse initiale VA
appartenant au plan xOy, incliné d'un angle a par rapport a l'horizontale a pour valeur VA=
54,0 m.s-1. On néglige les actions mécaniques liées à
l'air (forces de frottements et poussée d'Archimède) et on prend comme
nouvelle origine des temps l'instant où l' « étoile» est produite en A.
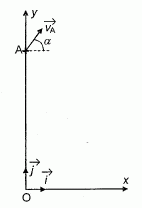
Dans le repère (0, i ,j ), en appliquant la seconde loi de Newton,
établir l'expression des composantes vx(t) et vy(t)
du vecteur vitesse du centre d'inertie d'une « étoile» de masse m.
L'étoile n'est soumise qu'à son poids ; la seconde loi de Newton donne
les composantes de l'accélération dans le repère : ( 0 ; -g )
Le vecteur vitesse est une
primitive du vecteur accélération et les composantes de la vitesse
initiale sont : (v0 cos a
; v0 sin a ).
Par suite : vx(t) = v0 cos a et vy(t) = -gt +v0 sin a .
Les courbes ci-dessous, représentent l'évolution temporelle des
composantes du vecteur vitesse.
Identifier, en justifiant, chacune de ces courbes.
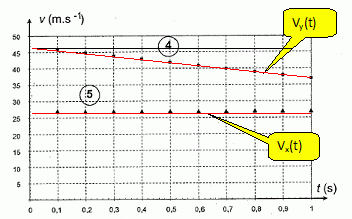
vx(t)
est une fonction constante positive : le graphe est une droite
horizontale.
vy(t)
est une fonction afine décroissante de coefficient directeur -9,8 ms-2.
En 1 s vy décroît d'environ 10 m/s.
Montrer que
l'équation de la trajectoire de l'étoile est : y =-½g
x2 / ( vA cos a
)2 + x tan a + OA.
De quel
type de trajectoire s'agit-il ?
Le vecteur position est une
primitive du vecteur vitesse ; les
composantes du vecteur position initiale sont : (0 ; OA )
Les composantes du vecteur position sont donc : x(t) = vA
cos a t ; z(t) =-½gt2
+ vA sin a t + OA.
x(t) = vA cos a
t donne t = x(t) / ( vA cos a )
repport dans y(t) : y =-½g x2 / ( vA cos a )2 +x tan a + OA.
Il s'agit d'une branche de parabole.
|
Emission
lumineuse.
Les « étoiles» en combustion produisent une f1amme colorée dont la
couleur dépend de leur composition chimique. La couleur bleue obtenue
est due a la désexcitation des molécules de chlorure de cuivre (I) CuCl.
Le spectre d'émission de la molécule CuCl excitée est composé de
plusieurs bandes centrées autour des longueurs d'onde suivantes dans le
vide: 395 nm ; 433 nm ; 435 nm ; 484 nm ; 488 nm ; 525 nm.
Donnees :
constante de Planck: h = 6,6 x 10-34 J.s
célérité de la lumière dans Ie vide: c = 3,0 x 108 m.s-1.
1 eV= 1,6 x 10-19 J
Le
spectre d'émission de la molécule CuCl appartient-il au domaine du
rayonnement visible, ultraviolet ou infrarouge ?
395
nm : domaine UV ; 433 nm ;
435 nm ; 484 nm ; 488 nm ; 525 nm : domaine visible
A quelle valeur de
la fréquence v correspond la
longueur d'onde 435 nm dans Ie vide ?
n = c / l = 3,0 x 108
/435 10-9 =6,9 1014 Hz.
Calculer I'energie
du photon correspondant en eV.
E = h n = 6,6 x 10-34
*6,9 1014
=4,55 10-19 J.
puis diviser par 1,6 x 10-19
: E = 2,8 eV.
L'élément
cuivre dans les pièces de monnaie.
On se propose dans cette partie de vérifier expérimentalement, par
spectrophotométrie, le pourcentage massique en cuivre dans un
échantiflon servant à fabriquer une pièce de 10 centimes d'euro.
Données:
Couples d'oxydoréduction Cu2+(aq) / Cu(s) ; N03-
(aq) / NO(g)
Masse molaire atomique: M(Cu) = 63,5 g.mol-1.
Masse molaire du sulfate de cuivre pentahydraté: M(CuS04, 5 H20)
= 249,6 g/mol
Le monoxyde d'azote NO(g) s'oxyde au contact du dioxygène de l'air en
dioxyde d'azote N02 (g), gaz roux et toxique, selon
l'équation chimique:
2 NO (g) + O2 (g) = 2 N02 (g)
Attaque du cuivre contenu dans la
pièce par une solution d'acide nitrique.
L'acide
nitrique (H30+ + N03- (aq)) est un oxydant puissant
capable d'oxyder des métaux tels que le cuivre Cu. Sous une hotte, dans un
becher, on place l'échantillon et on ajoute de l'acide nitrique
concentré en excès.
On observe au cours de cette transformation totale l'apparition d'une
teinte bleue foncée dans
la solution revelant la présence d'ion cuivre (II) Cu2+
et un
dégagement gazeux qui devient roux au contact de I'air.
Ecrire
les demi-équations d'oxydoréduction associées à chaque couple mis en
jeu lors de cette transformation
chimique.
oxydation : Cu(s) = Cu2+(aq) +2e-.
réduction : N03-
(aq) + 4H+ aq + 3e-= NO(g) + 2H2O(l).
|
Dosage
spectrophotométrique des ions cuivre (II) présents dans la solution S.
Une fois le dégagement gazeux achevé, on verse le contenu du becher
dans une fiole jaugée de 1,0 L et on complète jusqu'au trait de jauge
avec de l'eau distillée en homogénéisant le mélange afin de réaliser la
solution S.
Afin de réaliser une échelle de teintes, on prépare un volume Va
= 100 mL d'une solution « mère» S0 de sulfate de cuivre de
concentration molaire C0= 0,10 mol/L
Calculer
la masse de sulfate de cuivre pentahydraté à peser pour préparer cette
solution par dissolution.
Quantité de matière (mol) = volume de la solution ( L) * concentration
( mol/L)
n = Va C0 = 0,10*0,10 = 1,0 10-2
mol.
masse (g) = masse molaire (g/mol) * quantité de matière (mol)
m = 249,6 *0,01 = 2,496 g ~ 2,5 g.
La solution S0 permet de préparer par dilution une échelle
de teintes constituée des cinq solutions « fille » de volume V = 25,0
mL chacune. On mesure I'absorbance A à la longueur d'onde l= 810 nm.
A cette longueur d'onde seul l'ion Cu2+ (aq) est responsable
du phénomène d'absorption lumineuse.
solution
|
S0
|
S1 |
S2 |
S3 |
S4 |
concentration
(mol/L)
|
0,10
|
0,080
|
0,060
|
0,040
|
0,02
|
A
|
1,26
|
1,02
|
0,76
|
0,52
|
0,24
|
Calculer
le volume, noté Vmère, de solution «
mère» S0 à prélever pour
préparer la solution " fille " S3. Justifier.
facteur de dilution : F = 0,10 / 0,04 = 2,5.
Vmère =Vfille / F = V/F = 25 / 2,5 = 10 mL.
A I'aide
du spectre d'absorption d'une solution de sulfate de cuivre représenté
justifier le choix de la longueur d'onde retenue pour cette étude
expérimentale.
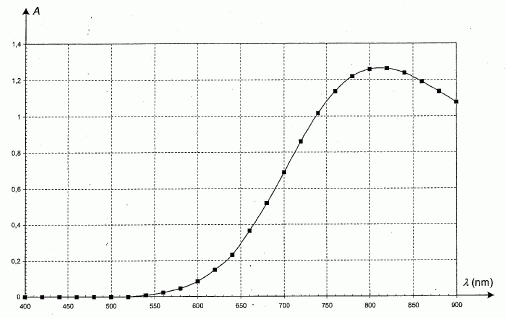
Afin d'obtenir la meilleur sensibilité, on choisit la longueur d'onde
correspondant au maximum d'absorption.
L'absorbance d'un échantillon de la solution S, mesurée dans les
mêmes conditions que précédemment à la longueur d'onde l= 810 nm, vaut As =
0,70. Le graphe donnant l'évolution de l'absorbance A en fonction de la
concentration c en soluté apporté des différentes solutions « fille »
est représentée.
En
déduire la concentration molaire volumique Cs de la solution S,
en justifiant graphiquement.
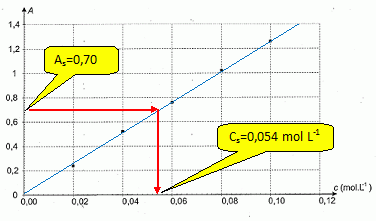
Pourcentage
massique de cuivre dans la pièce.
Toutes les pièces d'euros contiennent du cuivre métallique dans des
proportions particulières. Ainsi, les pièces de 10, 20 et 50 centimes
sont formées d'un alliage appelé « or nordique» dont la composition
massique est la suivante : 89 % de cuivre, 5% d'aluminium, 5% de zinc,
1 % d'étain.
En
utilisant Ie résultat de la question précédente, calculer la valeur de
la masse m(Cu) de cuivre contenue dans l'échantillon étudié précédemment.
1 L de la solution contient 0,054 mol d'ion cuivre II issu de n =0,054
mol de cuivre métal.
m(Cu) = n M(Cu) = 0,054*63,5 =3,43 g ~3,4 g.
Sachant que la masse de l'échantillon est m = 4,1 g, en déduire le
pourcentage massique du cuivre dans l'échantillon.
3,43 / 4,1 *100 = 83,6 ~84 %.
Comparer
ce résultat à la valeur fournie dans l'énoncé en calculant l'écart
relatif.
différence des valeurs / valeur moyenne * 100 = (89-83,6)*100 / 86,3 ~6,2 %.
|