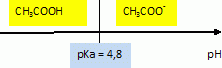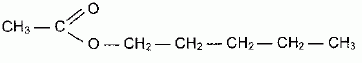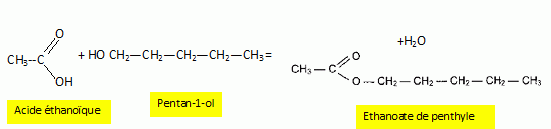On donne
: acide éthanoïque ou acétique CH3-COOH ; M = 60,0 g/mol ;
pKa( acide éthanoïque / ion éthanoate ) = 4,8.
Le titre ou l'acidité d'un vinaigre est donné en degré (°). 1,00°
correspond à 1,00 g d'acide éthanoïque pour 100 g de vinaigre. La masse
volumique du vinaigre vaut r
= 1010 g /L.
La
solution d'acide éthanoïque.
On prépare un volume V = 1,00 L d'une solution d'acide éthanoïque de
concentration molaire en soluté apporté C = 0,100 mol/L. Son pH est
égal à 2,9.
Ecrire
l'équation de la réaction entre l'acide éthanoïque et l'eau.
CH3-COOH aq + H2O(l) = CH3-COO- aq + H3O+aq.
Tracer le
diagramme de prédominance du couple acide éthanoïque / ion éthanoate.
Quelle espèce prédomine dans la solution ?
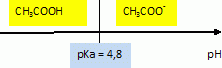
A pH=2,9, inférieur à pKa, la forme acide CH3-COOH prédomine.
Quotient de réaction à
l'équilibre.
Compléter
le tableau d'évolution donné.
|
avcancement
(mol)
|
CH3-COOH aq |
+ H2O(l) |
= CH3-COO- aq |
+ H3O+aq |
initial
|
0
|
CV =
0,100
|
solvant
|
0
|
0
|
en
cours
|
x
|
0,100-x
|
large
|
x
|
x
|
à
l'équilibre
|
xéq
|
0,100-xéq |
excès
|
xéq |
xéq |
|
Donner l'expression
du quotient de réaction à l'équilibre.
Qr, éq = [CH3-COO- aq]éq[H3O+aq]éq / [CH3-COOH aq]éq.
Montrer
que l'on a aussi Qr, éq =x2éq /
(V(CV-xéq)).
[CH3-COO- aq]éq= [H3O+aq]éq= xéq/V et [CH3-COOH aq]éq= (CV-xéq )/ V.
par suite : Qr, éq =x2éq /
(V(CV-xéq)). |
Comment s'exprimme xéq
en fonction du pH ?
[H3O+aq]éq= xéq/V avec [H3O+aq]éq= 10-pH d'où : xéq = V 10-pH.
Calculer Qr,
éq.
Qr, éq = 10-2pH / (C-10-pH)= 10-5,8 / (0,100-10-2,9)
=1,60 10-5.
A quelle grandeur
caractéristique du couple acide éthanoïque / ion éthanoate
s'identifie-t-il ? Vérifier que la valeur obtenue est en accord
avec une donnée de l'exercice.
Le quotient de réaction à l'équilibre s'identifie avec la constante
d'acidité Ka.
Le texte donne pKa = 4,8 soit Ka = 10-4,8 =1,58 10-5
~1,6 10-5.
Définir
et calculer le taux d'avancement final. La transformation est-elle
totale ?
Le taux d'avancement final t
est égal au rapport de l'avancement final à l'avancement maximal : t = xf / xmax
=10-pH / C =10-2,9/0,100= 1,26 10-2 ~1,3 10-2.
Etude d'un
vinaigre.
Un vinaigre de vin titrant 7,5° et un vinaigre d'alcool titrant6,0° ont
été versés dans deux flacons non étiquetés. On cherche à les identifier
par des mesures pHmétriques.
préciser,
par un raisonnement sans application numérique, quel est le vinaigre de
plus faible pH ?
Le pH est d'autant plus petit que la concentration en ion oxonium est
plus grande.
7,5° correspond à 7,5 g d'acide éthanoïque pour
100 g de vinaigre ; 6,0° correspond à 6,0 g d'acide éthanoïque pour
100 g de vinaigre
Le vinaigre de vin a une concentration C plus grande en acide
éthanoïque que le vinaigre d'alcool.
Or [H3O+aq]2éq~ Ka C avec Ka constant à température constante.
Par suite, le vinaigre de vin a le plus petit pH.
On choisit de réaliser un dosage pHmétrique de l'un des deux vinaigres
par une solution aqueuse d'hydroxyde de sodium ( Na+aq
+ HO-aq).
Ecrire l'équation de
la réaction support du dosage.
HO-aq + CH3-COOH aq = CH3-
COO-aq + H2O(l).
Calculer la
constante d'équilibre K associée à l'équation de cette réaction.
K = [CH3- COO-aq] / ([CH3-COOH aq][HO-aq]) avec [CH3- COO-aq] / [CH3-COOH aq] = Ka / [H3O+aq].
K = Ka / ( [H3O+aq][HO-aq]) = Ka / Ke = 10-4,8
/ 10-14 = 109,2 =1,6 109.
On peut
conclure à partir de la valeur de K que la réaction est totale.
Quelle
autre caractéristique doit-elle posséder pour servir de support de
dosage ?
La réaction doit en plus être rapide.
On dilue l'un des deux vinaigres de concentration C0 d'un
facteur 10. La concentration de la solution diluée est notée CA.
Décrire
la préparation de 50,0 mL de vinaigre dilué en précisant la verrerie
utilisée.
Prélever 50,0 / 10 =5,00 mL de solution mère à l'aide d'une pipette
jaugée.
Placer dans une fiole jaugée de 50,0 mL et compléter avec de l'eau
distillée jusqu'au trait de jauge.
Boucher, agiter pour rendre homogène.
On dose un volume VA =10,0 mL de vinaigre dilué auquel on a
ajouté 20 mL d'eau distillée. La concentration CB de la
solution aqueuse d'hydroxyde de sodium est de 0,10 mol/L. La
courbe expérimentale est donnée.
Pourquoi ajoute-t-on de l'eau distillée ? Cet ajout modifie-t-il le
volume VE versé à l'équivalence ?
L'ajout d'eau distillée permet d'imerger correctement l'extrémité de la
sonde de mesure du pHmètre. L'eau distillée n'apportant pratiquement
pas d'ion oxonium, le volume VE n'est pas modifié.
Déterminer
VE et le pH à
l'équivalence en utilisant le graphique.
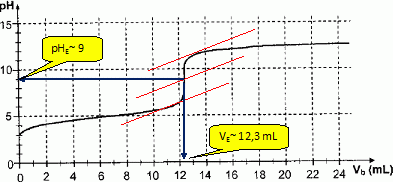
En
déduire CA puis C0, le titre du
vinaigre et la nature deu vinaigre.
A l'équivalence CAVA = CB VE
; CA = CB VE / VA= 0,10 * 12,3 /
10 =0,123 mol/L ~0,12 mol/L
Par suite C0 = 10 CA = 1,2 mol/L.
Masse d'acide éthanoïque dans 1 L de vinaigre : 1,23 * 60 = 73,8 g ou
7,38 g dans 100 mL de vinaigre
masse de 1 L de vinaigre : 1010 g ; masse de 100 mL de vinaigre : 101 g;
titre : 7,38 / 101 ~7,3° ; il s'agit du vinaigre de vin.
|
Synthèse d'un
ester.
On souhaite synthétiser
un ester à odeur de poire, l'éthanoate de pentyle, à l'aide de
l'acide éthanoïque et d'un alcool. La formule de l'ester est donnée
ci-dessous :
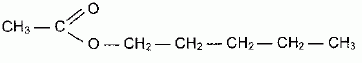
Ecrire
l'équation de la réaction et préciser les noms des réactifs.
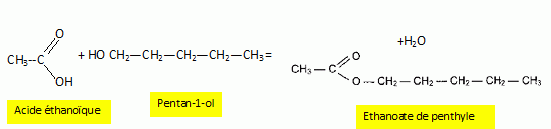
Quelles sont les
caractéristiques de cette transformation ?
L'estérification est lente, athermique, limitée par l'hydrolyse de
l'ester.
On utilise pour la synthèse le montage schématisé ci-dessous.
Comment
s'appelle ce montage ? Compléter la légende.
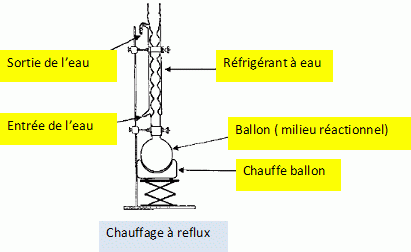
|
|