|
Titrage acido-basique et estérification : bac S Inde 2010
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
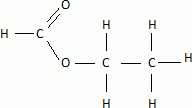
Titrage acidobasigue -estérification : (4 points) On dispose d'une solution commerciale S0 d'acide méthanoïque HC02H dont les caractéristiques sont les suivantes : • Pourcentage massique en acide méthanoïque: P =82% On rappelle la définition du pourcentage massique : masse d'acide méthanoïque pur contenu dans un volume V de solution P / masse du volume V de solution x 100. • Densité: d = 1 ,18• Masse volumique de l'eau: reau =1,00 x 103 g / L. • Masse molaire: M =46,0 g/ mol Partie 1. Vérifier que la concentration de la solution commerciale S0 en acide méthanoïque est C0 =21 mol.l-1. Masse de 1 L de solution commerciale 1,18 kg = 1180 g Masse d'acide méthanoïque pur dans 1 L de solution : m = 0,82 * 1180 =967,6 g Quantité de matière d'acide dans 1 L ( concentration molaire ) : m / M = 967,6 / 46 =21,0 ~21 mol/L. On souhaite préparer une solution diluée S d'acide méthanoïque de concentration C =0,21 mol/L à partir de la solution commerciale S0. On dispose du matériel suivant : fioles jaugées: 100 mL ; 200 mL ; 500 mL ; 1,00 L ; pipettes jaugées: 10,0 mL ; 20,0 mL ; 50,0 mL. Après justification pour la verrerie utilisée, indiquer le mode opératoire nécessaire à la préparation de la solution diluée S à partir de S0. Facteur de dilution 21 / 0,21 = 10 ; il s'agit d'une dilution au 100è. Le volume de la fiole jaugée doit être 100 fois plus grand que celui de la pipette jaugée. Prélever 10,0 mL de la solution mère à l'aide d'une pipette jaugée de 10,0 mL + pipeteur. Placer dans la fiole jaugée de 1,00 L; compléter avec de l'eau distillée jusqu'au trait de jauge. Boucher et agiter pour rendre homogène. On souhaite préparer un composé odorant présent dans les arômes de pomme ou d'orange. Pour cela, on fait réagir de l'acide méthanoïque avec de l'éthanol en présence d'acide sulfurique concentré (catalyseur). Compléter l'équation citée dans l'annexe 1 et nommer les produits formés. Représenter la formule développée de l'ester obtenu.
Mode opératoire : On introduit dans un ballon ni(A) = 0,200 mol d'acide méthanoïque, ni(B) = 0,500 mol d'éthanol et 5 gouttes d'acide sulfurique concentré en présence de quelques grains de pierre ponce. On chauffe, à reflux, le mélange pendant une heure. Après refroidissement, on titre les acides (méthanoïque et sulfurique) présents par une solution d'hydroxyde de sodium de concentration CB =1,6 mol.L-1 ; l'équivalence est obtenue pour un volume versé VB1 =18,7 mL. Un titrage préalable montre que 5 gouttes d'acide sulfurique concentré sont neutralisées par un volume VB2 =3,7 mL de solution d'hydroxyde de sodium. Ecrire l'équation de la réaction entre l'acide méthanoïque et l'ion hydroxyde. Couples acide / base : HCO2H aq / HCO2-aq et H2O(l) / HO- aq. HCO2H aq + HO- aq = HCO2-aq +H2O(l) Quel volume de base noté VB3 est nécessaire pour titrer l'acide méthanoïque restant ? VB3 =VB1 -VB2 =18,7 -3,7 = 15,0 mL. En exploitant l'équivalence du titrage, montrer que la quantité n(A) d'acide méthanoïque présent dans le ballon (en fin d'estérification) est égal à 2,4 x 10-2 mol. A l'équivalence, les quantités de matière d'acide méthanoïque et d'hydroxyde de sodium sont en proportions stoechiométriques : n(A) = CB VB3 =1,6 * 15,0 10-3 =2,4 10-2 mol.
En exploitant, si besoin, le tableau d'avancement de l'annexe 1 , déterminer la valeur de l'avancement final, xf, de la réaction d'estérification.
0,200-xf =2,4 10-2 ; xf = 0,176 mol~0,18 mol.
|
|||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||
|
|