Pour une
infection provoquée par le virus Influenza, deux types de traitements
peuvent
être prescrits aux patients : les traitements symptomatiques tels
que les
antipyrétiques (paracétamol, ibuprofène, …) et les traitements
antiviraux
(oséltamivir, zanamivir,…).
Dans
un
laboratoire, on reçoit deux comprimés : l’un étant de l’
« ibuprofène
100 mg » et l’autre de l’« oséltamivir 75 mg ». Ces
médicaments
contiennent un principe actif différent et d’autres espèces chimiques
appelées
excipients. Le principe actif est l’espèce chimique utile au
traitement. Par
exemple, pour le comprimé « ibuprofène 100 mg », il s’agit de
l’ibuprofène.
Dans cet exercice
on se propose de vérifier l’identité des deux comprimés, puis de
réaliser le
dosage pH-métrique
de l’ibuprofène et enfin d’étudier quelques propriétés de
l’oséltamivir.
Identification
des comprimés d’ibuprofène et de
l’oséltamivir
Analyse
chromatographique :
On
réalise une
chromatographie sur couche mince des deux comprimés reçus que l’on
nomme
arbitrairement A et B. L’éluant est un mélange complexe de solvants
organiques.
Identifier,
en justifiant les réponses, les deux comprimés A et B à partir du
chromatogramme représenté.
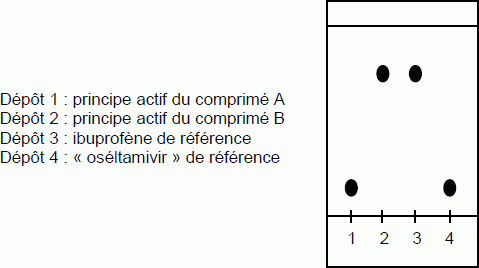
Dans
le composé A, on identifie l'oséltamivir (
même rapport frontal, ,
grandeur caractéristique d'une espèce pour un solvant donné ),
tandis que dans le comprimé B, on identifie l'ibuprofène ( les
deux taches 2 et 3 sont à la même hauteur, même rapport frontal ).
|
Principe
actif.
Données : masse
molaire de
l’ibuprofène : Mi =
206 g.mol–1 ; masse molaire de
l’oséltamivir : Mo =
312 g.mol–1.
La masse du comprimé d’
«ibuprofène 100 mg » est de
300 mg. Celle du comprimé d’« oséltamivir 75 mg » est de 225
mg.
Expliquer
la différence entre les masses annoncées et les masses mesurées.
«ibuprofène 100 mg » : 100 mg
d'ibuprofène, principe actif, dans un comprimé de masse totale 300 mg (
principe actif + excipients
).
« oséltamivir 75 mg » : 75 mg d'oséltamivir, principe actif, dans un comprimé de masse
totale 225 mg ( principe actif + excipients
).
|
Déterminer
la quantité de matière de principe actif contenu dans le comprimé d’
«ibuprofène 100 mg ».
ni = m / Mi = 0,100 / 206 = 4,8544 10-4
~4,85 10-4 mol.
Calculer la
masse d’oséltamivir correspondant à la même quantité de matière.
m0 = ni Mo =
4,8544 10-4 *312 =0,151 g.
Les
deux
comprimés contiennent-ils la même quantité de matière de leur principe
actif ? Justifier.
Le
comprimé d’« oséltamivir 75 mg » contient 75 mg de principe
actif soit 0,075 / 312 = 2,40 10-4 mol. Le comprimé
d'ibuprofène contient 4,85 10-4 mol de principe actif.
Les deux comprimés ne contiennent donc pas la même quantité de matière
de principe actif.
Dosage
pH-métrique de l’ « ibuprofène »
On souhaite vérifier
la masse d’ibuprofène présente
dans un comprimé. L’ibuprofène a été synthétisé pour la première fois
dans les
années 1960.
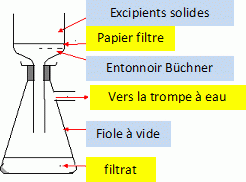
Préparation
de la
solution aqueuse d’ibuprofène.
On broie puis on
dissout le comprimé contenant l’ibuprofène dans 30 mL d’éthanol. Les
excipients
y sont insolubles. On filtre alors sous vide le mélange. Le filtrat,
contenant
l’ibuprofène dissous, est dilué dans 70 mL d’eau. On obtient une
solution S
d’ibuprofène dont on admet qu’elle a le même comportement qu’une
solution
aqueuse.
Légender
le schéma suivant : utiliser les mots du tableau.

Expliquer
pourquoi la filtration sous vide est préférée à la filtration simple.
La filtration sous vide est rapide et permet d'éliminer pratiquement
tout le solvant.
Réalisation
du
dosage pH-métrique de l’ibuprofène.
On dose
l’ibuprofène contenu dans la solution S à l’aide d’une solution aqueuse
d’hydroxyde de sodium (Na+ + HO–) de
concentration en
soluté apporté CB = 5,00 x 10–2 mol.L–1. La mesure
du pH permet de tracer les
courbes pH = f(V) et dpH/dV = f(V).
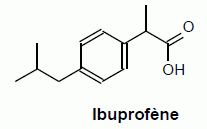
À l’aide
de
la formule de l’ibuprofène
expliquer pourquoi il est possible de doser la solution S par une
solution
d’hydroxyde de sodium.
On note
l’ibuprofène AH. Écrire l’équation de
la réaction support du dosage
Couples acide / base : AH aq / A-aq
et H2O(l) / HO-aq
AH aq + HO-aq = A-aq + H2O(l).
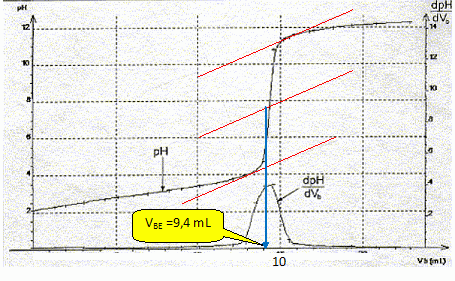
À l’aide des courbes,
justifier qu’aux erreurs de mesure près, le volume versé à
l’équivalence est VBE
= 9,4 mL.
Parmi
les propositions ci-dessous, choisir, en le
justifiant, l’expression littérale correcte pour déterminer la masse
effective m
d’ibuprofène dans le comprimé où Mi
est la masse molaire de
l’ibuprofène. Calculer
cette masse et conclure.

A
l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques. On note nA la quantité de
matière dibuprofène :
nA= CB
VBE ; masse effective d'ibuprofène : m = nAMi
= CB VBE Mi =5,00 x 10–2 *
9,4 10-3 * 206 =0,0968 g = 97 mg.
Ecart relatif ( 100-97) / 100 = 0,03 ( 3%). La valeur expérimentale est
en accord avec l'indication " 100 mg" de principe actif.
|
Propriétés de
l’oséltamivir.
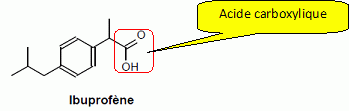
L’oséltamivir
a été développé vers 1995. Sa formule
semi-développée est :
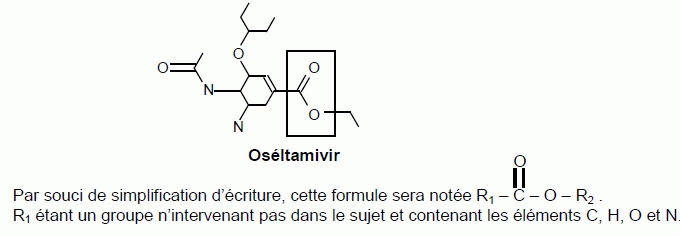
Nommer le groupe caractéristique
encadré.
Donner la formule
semi-développée du groupe R2.
Le groupe
encadré est le groupe correspondant à la fonction ester.
R2 compte deux atomes de carbone et la chaîne carbonée est
saturée : CH3--CH2--.
L’oséltamivir,
une fois ingéré, est transformé par une enzyme en ion
carboxylate ;
celui-ci agit alors sur le virus. On admet que l’enzyme joue le même
rôle que
l’ion hdroxyde HO– sur le groupe caractéristique encadré.
Écrire
la réaction entre l’oséltamivir et l’ion hydroxyde.
R1-COOR2
+ HO- = R1-COO-
+ R2OH
Comment
nomme-t-on cette réaction ?
Hydrolyse basique (
saponification ) d'un ester.
Donner
les deux caractéristiques de la réaction
chimique précédente.
L'hydrolyse basique d'un
ester est lente et totale.
Première étape
de la synthèse de l’oséltamivir.
En
2005, il a été
révélé que l’oséltamivir était produit à partir de l’acide shikimique contenu
dans la badiane
chinoise, aussi appelée anis étoilé et cultivée dans le sud de la
Chine. Cet
acide, qui ne présente aucune activité antivirale, subit de multiples
transformations avant de devenir l’oséltamivir. La première étape est
une
estérification entre l’acide shikimique et l’éthanol.
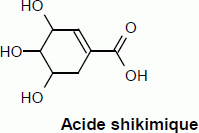
Écrire l’équation de
la réaction d’estérification entre
l’acide shikimique et l’éthanol, en formule semi-développée.
R-COOH + C2H5OH
=R-COO- C2H5+
H2O.
Citer
deux caractéristiques de cette réaction d’estérification.
L'estérification est lente et limitée par
la réaction inverse, l'hydrolyse.
|
Synthèse de
l’ester.
On
dissout 200 mg d’acide shikimique dans 10 mL d’éthanol et on ajoute
quelques
gouttes d’acide sulfurique, ainsi que quelques grains de pierre ponce.
On
chauffe à reflux le mélange réactionnel.
Parmi
les trois propositions ci-dessous, choisir le schéma correct
correspondant au
protocole décrit :
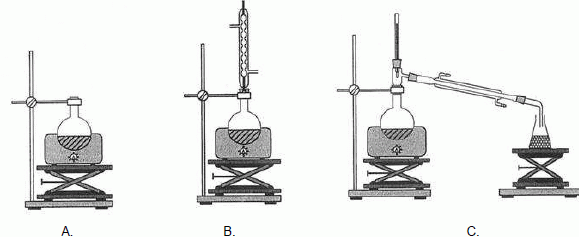
Le montage B correspond au chauffage à reflux.
Quel est le rôle du
réfrigérant à eau ?
Les vapeurs qui montent dans le réfrigérant à eau se condensent et
retombent dans le milieu réactionnel. Il n'y a pas de pertes de matière.
Quel
est l’intérêt de chauffer le mélange réactionnel ?
On augmente la vitesse de la réaction d'estérification.
Quel
est l’intérêt d’ajouter de l’acide sulfurique ?
L'acide sulfurique catalyse la réaction.
Rôles
de l’éthanol.
Parmi
les propositions ci-dessous, choisir la (ou les) réponse(s) correcte(s)
relative(s) au(x) rôle(s) joué(s) par l’éthanol :
A.
catalyseur
B. réactif
C. solvant
L'éthanol est l'un des réactifs ; il joue également le rôle de solvant.
Quel
est l’intérêt d’utiliser l’éthanol en excès sur l’état d’équilibre du
système ?
En utilisant un réactif en excès, l'équilibre est déplacé dans le sens
direct, formation de l'ester : on augmente ainsi le rendement.
Une
réaction est-elle possible entre deux groupes caractéristiques de deux
molécules d’acide shikimique ? Justifier.
L'acide shikimique possède à la fois un groupe acide carboxylique et
plusieurs groupes hydroxy ( fonction alcool) : une réaction est donc
possible entre deux molécules d'acide shikimique.