La
photographie, ci-dessous, est celle d’une « égoïste ». Il s’agit d’une
théière de salon, pour une seule personne, datant du début du XIXème
siècle. Elle est en laiton (alliage de cuivre et de zinc) et, à
l’origine, elle était recouverte d’argent métallique qui a disparu au
fil des années.
Pour redonner à ce type de pièce leur éclat d’antan, les orfèvres
savent déposer une mince couche adhérente d’argent par électrolyse.
Outre l’embellissement de l’objet traité, cette opération permet de le
protéger de l’attaque de l’air et des aliments acides et lui confère
des propriétés germicide et bactéricide.

L’objectif de cet exercice est d’étudier le principe de cette
électrolyse, dite à anode soluble, qui permet de déposer une fine
couche d’argent sur une pièce métallique.
Données :
- couple oxydant/réducteur : Ag+(aq) / Ag(s) ; masse
molaire atomique de l’argent : M(Ag) = 108 g.mol−1 ;
- masse volumique de l’argent : ρ (Ag) = 10 g.cm−3 ;
constante d’Avogadro : NA = 6,0 × 1023 mol−1
; charge électrique élémentaire : e = 1,6 × 10−19 C.
Principe
de l’argenture électrolytique.
Avant de recevoir l’argenture, la théière subit plusieurs traitements
de la part de l’orfèvre : le métal est aplani, décapé, poli et
dégraissé de manière à ce que le dépôt d’argent adhère bien par la
suite.
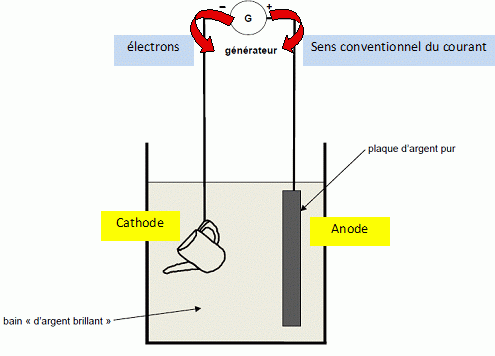
La théière, une fois prête à recevoir l’argenture (figure 4), est
plongée dans un bain nommé bain « d’argent brillant », solution
contenant entre autres des ions dicyanoargentate en équilibre avec des
ions argent.
La théière plongée dans ce bain joue le
rôle de cathode. Des plaques d’argent pur, placées de chaque côté du
bain, jouent le rôle d’anode. Un générateur de basse tension délivre
dans l’électrolyseur ainsi constitué
un courant d’intensité constante dont on peut régler la valeur.
On
a simplifié le circuit d’électrolyse en résumant l’action des deux
plaques d’argent en une seule sur la figure suivante.
Indiquer
sur ce schéma, le sens conventionnel du courant électrique et le sens
de déplacement des électrons.
Dans le bain « d’argent brillant », les ions argent réagissent à la
cathode (notée 1) selon l’équation :
Ag+ 1(aq) + e− = Ag 1 (s)
Quel est
l’intérêt d’avoir utilisé la théière comme cathode ?
A la cathode on observe un dépôt d'argent sur l'électrode ; l'objet à
recouvrir doit donc servir de cathode.
À l’anode (notée 2), l’argent métallique Ag2(s) des plaques
réagit, écrire
l’équation de la réaction à cette électrode. De quel type de
réaction s’agit-il ?
On notera Ag+ 2(aq) les ions argent
intervenant à cette électrode.
Oxydation à l'anode du métal arent constituant l'électrode : Ag2(s) = Ag+ 2(aq)
+e− .
Ecrire l’équation de
la réaction chimique ayant lieu lors de l’électrolyse. Pourquoi
appelle-t-on cette électrolyse « électrolyse à anode soluble » ?
Addition
des deux demi-équations électroniques :
Ag+ 1(aq) + e− + Ag2(s) = Ag 1 (s) +Ag+ 2(aq)
+e− .
Simplifier : Ag+ 1(aq)
+ Ag2(s) = Ag 1 (s) +Ag+ 2(aq)
.
Tout se passe comme s'il y avait transfert de l'argent de l'anode à la
cathode. L' argent métal s'oxyde à l'anode ; la masse de cette dernière
diminue d'où le nom "anode soluble".
Étude
quantitative de l’électrolyse.
On souhaite argenter extérieurement et intérieurement la théière qui
possède une surface totale S = 850 cm2 par un dépôt uniforme
d’argent. La théière, qui joue le rôle de cathode, est plongée
entièrement dans le bain
d’argent brillant pendant une durée Δt = 35 min. L’intensité du courant
délivrée par le générateur est constante et vaut I = 7,0 A.
Donner l'expression de la quantité d'électricité Q qui a traversé l'électrolyseur pendant une durée Dt.
Q = I Dt.
On note n(e-) la quantité de matière d'électrons échangés pendant cette durée Dt.
Donner l'expression de Q en fonction de n(e-), NA et e.
La charge, en valeur absolue, d'une mole d'électrons est : 1 F = NA e.
Par suite Q = n(e-)F = n(e-)NA e.
n(e-) = Q / (NA e).
Montrer que la masse d’argent métallique m(Agdép ) déposée sur la
théière pendant l’électrolyse a pour expression : .
m(Agdép ) = I Dt / (NA e) M(Ag)
n(e-) = Q / (NA e) = I Dt / (NA e).
Ag+ 1(aq) + e− = Ag 1 (s)
D'après les nombres stoechiométriques de cette demi-équation, la
quantité de matière d'électron est égale à la quantité de matière
d'argent déposé.
m(Agdép ) = n(Agdép ) * M(Ag) = n(e-) * M(Ag) ;
m(Agdép ) = I Dt / (NA e) M(Ag)
A.N. m(Agdép ) = 7*35*60 / (6,0 1023*1,6 10-19) *108 = 16,53 ~17 g.
Sur la figure 4, on voit que la théière est suspendue entre deux
plaques d’argent jouant le rôle d’anode.
Quel avantage présente ce dispositif pour le dépôt d’argent sur la
théière ?
Le dépôt d'argent est uniforme sur toutes les faces de l'objet.
|
Qualité du dépôt d'argent sur la théière.
Une fois l’électrolyse terminée, l’orfèvre doit appliquer un poinçon.
Ce poinçon comporte les chiffres I ou II
selon la qualité de fabrication correspondant à une certaine couche
d’argent déposée sur la pièce (figure 6).

Les qualités I ou II dépendent de
l’épaisseur moyenne du dépôt d’argent sur l’objet et du type d’objet
argenté
comme le montre le
tableau ci-dessous :
|
épaisseur moyenne minimale d'argent en µm
|
|
couvert d'usage fréquent
couteaux, fourchettes
|
couvert d'usage occasionnel
couteaux, fourchettes |
plats, théière, timbale
|
bougeoirs, vases
|
qualité I
|
23
|
19
|
15
|
10
|
qualité II
|
20
|
12
|
9
|
6
|
Exprimer le volume V(Agdép) d’argent
déposé sur la théière au cours de l’électrolyse en fonction de m(Agdép ) et ρ (Ag).
V(Agdép) = m(Agdép ) / ρ (Ag)
Calculer l’épaisseur moyenne d
d’argent déposé sur la théière au cours de l’électrolyse.
d = V(Agdép) / S = m(Agdép ) / (ρ (Ag) S)
avec : m(Agdép ) en gramme ; ρ (Ag) en g cm-3 ; S en cm2 et d en cm.
d = 16,53 / ( 10*850 ) =1,94 10-3 cm ~19 µm.
Déduire des données du tableau ci-dessus, le poinçon de l’orfèvre
à appliquer sur la théière restaurée.
d est supérieur à 15 µm pour une théière : donc qualité I.
|
|



