Faire
le tour de la Méditerranée à bord d’un voilier dont le moteur
auxiliaire est sans rejet direct de gaz carbonique, tel est le défi du
projet « Zéro CO2 ».
Présenté pour la première fois en Europe, au salon nautique de Paris en
décembre 2009, un voilier de 12 m sera équipé d’un moteur électrique
auxiliaire alimenté par une pile à combustible à hydrogène.
Ce projet doit permettre de tester un bateau aux énergies renouvelables et
au dihydrogène pour promouvoir un littoral économe et respectueux de
l’environnement. L’industrie automobile a développé la pile GÉNÉPAC :
c’est la pile à combustible choisie pour le projet « Zéro CO2 ».
D’après les sites Internet : « http://www.zeroCO2sailing.com », « http://www.cea.fr »,« http://www.psa-peugeot-citroen.com ».
Le principe de la pile à combustible est le suivant : une
réaction électrochimique contrôlée, entre du dihydrogène et le
dioxygène de l’air, produit simultanément de l’électricité, de l’eau et
de la chaleur.
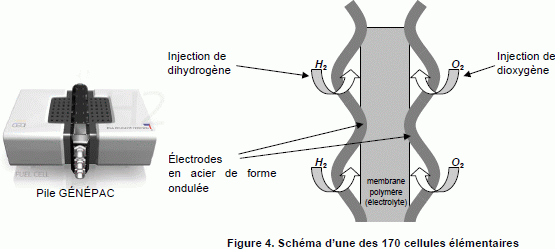
Cette réaction s’opère au sein d’une cellule élémentaire composée de
deux électrodes, de forme ondulée, séparées par un électrolyte (figure
4).
L’électrolyte est constitué d’une membrane polymère échangeuse de protons H+.
Cette pile est un empilement de 170 cellules élémentaires identiques.
Le dihydrogène est stocké à bord sous forme de gaz comprimé à la pression de 700 bars ; le volume du réservoir est V = 15,0 L.
Lorsque le réservoir de dihydrogène est plein, la masse du dihydrogène disponible est de 3,0 kg.
Dans cet exercice, on étudie le principe de fonctionnement d’une cellule élémentaire et la durée d’autonomie de la pile GÉNÉPAC.
On donne : M(H) = 1 g/mol ; M(O) = 16 g/mol ; NA = 6,0 1023 mol-1 ; constante des gaz parfaits R = 8,32 J mol-1 K-1.
Pression normale P0 = 1,01 105 Pa ; température normale T0 = 273 K ; charge élémentaire e = 1,6 10-19 C.
Couples oxydant / réducteur : H+aq / H2(g) et O2(g) / H2O(l).
Principe de fonctionnement d'une cellule élémentaire.
Ecrire
les équations des réactions à chaque électrode quand la pile débite en
précisant s'il s'agit d'une oxydation où d'un réduction.
Oxydation de H2(g) à l'anode négative : 2H2(g) = 4e- + 4H+aq
Réduction de O2(g) à la cathode positive : O2(g) + 4e- + 4H+aq = 2H2O(l).
Addition de ces deux demi-équations électroniques pour obtenir le bilan de fonctionnement de la pile :
2H2(g) + O2(g) + 4e- + 4H+aq = 4e- + 4H+aq + 2H2O(l).
Simplifier : 2H2(g) + O2(g) = 2H2O(l).
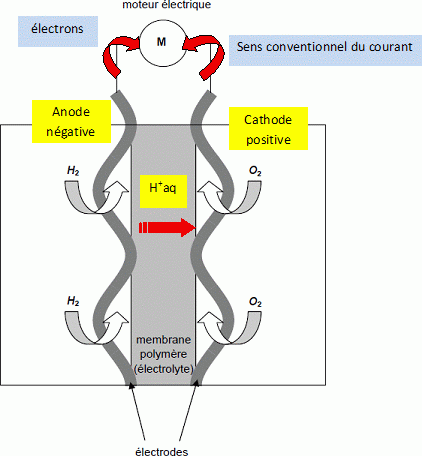
Sur la figure suivante indiquer :
- le sens de circulation et la nature des porteurs de charges circulant à l'extérieur de la pile ;
- le sens conventionnel du courant électrique ;
- la polarité de chaque électrode ;
- le sens de circulation des protons H+ dans la membrane polymère ( électolyte ).
Quel peut être l'intérêt d'utiliser des électrodes ondulées plutôt que des électrodes planes ?
La surface de contact entre les gaz et les électrodes est plus importante, ce qui augmente la production d'électricité.
Durée d'autonomie de la pile.
Les
170 cellules élémentaires constituant la pile sont montées en série.
Dans certaines conditions d'utilisation, on peut considérer que le
courant circulant dans les cellules élémentaires est constant,
d'intensité I = 120 A.
En utilisant la masse de dihydrogène disponible dans le réservoir, calculer la quantité de matière de dihydrogène nR(H2) correspondante.
nR(H2) = m / M(H2) = 3000 / 2 = 1,5 103 mol.
Déterminer le volume V0 de dihydrogène, dans les conditions normales de température et de pression, qu'il a fallu comprimer pour remplir le réservoir.
Loi des gaz parfaits : P0 V0 = nR(H2) R T0 ; V0 = nR(H2) R T0 / P0 ;
V0 =1,5 103 *8,32 *273 / 1,01 105 =33,7 ~34 m3.
On note nC(H2) la quantité de matière de dihydrogène disponible pour chaque cellule élémentaire.
Quelle est la relation entre nC(H2) et nR(H2) ?
nC(H2) = nR(H2) / 170.
|
Quantité d'électricité.
On note Dt la durée de fonctionnement d'une cellule élémentaire.
Donner l'expression de la quantité d'électricité Q échangée par une cellule élémentaire pendant une durée Dt.
Q = I Dt.
On note n(e-) la quantité de matière d'électrons échangés pendant cette durée Dt.
Donner l'expression de Q en fonction de n(e-), NA et e.
La charge, en valeur absolue, d'une mole d'électrons est : 1 F = NA e.
Par suite Q = n(e-)F = n(e-)NA e.
Donner la relation entre n(e-) et nC(H2). Justifier.
H2(g) = 2e- + 2H+aq
d'après les nombres stoechiométriques de cette demi-équation : n(e-) = 2 nC(H2).
Par construction, la durée de fonctionnement de la pile est égale à la durée de fonctionnement Dt d'une cellule élémentaire.
Montrer que Dt = 2nC(H2)NA e / I.
Q = n(e-)F = n(e-)NA e = I Dt avec n(e-) = 2 nC(H2).
2 nC(H2)NA e = I Dt ; Dt = 2nC(H2)NA e / I.
A.N : Dt =2*1,5 103 /170 *6,0 1023 *1,6 10-19 / 120 = 1,4 104 s = 3,9 heures.
|
|