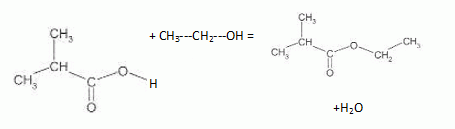On
désire synthétiser le 2-méthylpropanoate d'éthyle, ester à odeur de
fraise dont la formule semi-développée est donnée.
Comment
peut-on obtenir cet ester ?
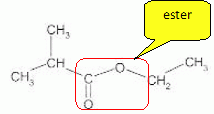
Entourer
le groupe caractéristique de la fonction ester.
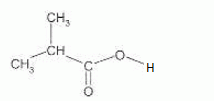
Ecrire la
formule semi-développée de l'acide carboxylique, noté A, permettant
d'obtenir cet ester.
Indiquer
le nom et la formule semi-développée de l'alcool, noté B, permettant de
synthétiser cet ester.
CH3--CH2--OH, alcool éthylique ou éthanol.
|
Ecrire l'équation de
la réaction d'estérifcation correspondante.
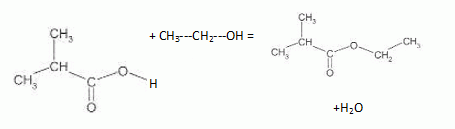
Citer
deux caractéristiques des transformations associées à cette réaction.
L'estérification est lente, limitée par
l'hydrolyse de l'ester.
|
Comment peut-on
améliorer cette synthèse ?
Afin de synthétiser cet ester au laboratoire, on
introduit une quantité de matière nA = 1,00 mol de l'acide A
et un volume VB = 58,4 mL de l'alcool B. On ajoute de
l'acide sulfurique et on chauffe à reflux ce mélange.
On donne : masse volumique de l'alcool B : µB = 0,789 g / mL
; masse molaire de l'alcool B : 46,07 g/mol.
Calculer la quantité
de matière nB d'alcool B introduit dans le mélange.
masse d'alcool m = µB VB = 0,789*58,4 =46,08 g
nB = m / M(B) = 46,08 / 46,07 = 1,00 mol.
Le mélange réalisé
est-il équimolaire ? Justifier.
D'après les nombres stoechiométriques de la réaction d'estérification,
une mole d'alcool réagit avec une mole d'acide carboxylique. Le mélange
est donc équimolaire.
Quel est
l'intérêt de chauffer le mélange réactionnel ?
La température est un facteur cinétique. En travaillant à température
plus élevée, on augmente la vitesse des réactions d'estérification et
d'hydrolyse : l'équilibre est plus rapidement atteint.
L'acide sulfurque joue le rôle de catalyseur.
Donner la
définition d'un catalyseur.
Un catalyseur, introduit en quantité très faible, augmente la vitesse
de la réaction. Le catalyseur est régénéré en fin de réaction et
n'apparaît pas dans le bilan.
Dans le cas de deux réactions compétitives, un catalyseur peut
favoriser l'une des réactions.
Pour améliorer le rendement de cette synthèse, on peut remplacer
l'acide carboxylique A par un de ses dérivés.
A quelle
famille appartient ce dérivé ?
anhydride d'acide ou chlorure d'acyle.
Quelle
autre méthode pourriez-vous proposer pour améliorer le rendement de
cette synthèse ?
Ajouter l'un des réactifs en excès ou bien éliminer l'un des produits
au fur et à mesure de sa formation par distillation.
Etude d'une transformation chimique.
Au
cours d'une séance de TP, un profeseur propose à ses élèves de
déterminer la valeur du taux d'avancement final d'une transformation en
effectuant une mesure pH-métrique et une mesure conductimétrique.
Solution de départ.
Une solution S0 d'un acide AH porte les indications suivantes :

Pour la suite, tant qu'il n'a pas été identifié, l'acide contenu dans la bouteille sera noté AH et sa base conjuguée A-.
Donner la définition d'un acide selon Brönsted.
Un acide est une espèce, ion ou molécule, susceptible de céder un proton H+.
Quelles précautions faut-il prendre pour manipuler ce produit ?
Le produit étant corrosif, il faut porte une blouse, des gants et des lunettes de protection.
Le produit étant irritant pour les voies respiratoires, il faut travailler sous hotte.
Accès à la valeur du taux d'avancement final par une mesure pH-métrique.
Dans une fiole jaugée de volume V = 500,0 mL, partiellement remplie
d'eau distillée, le professeur verse avec précautions 1,00 mL de la
solution S0 d'acide AH, puis il complète jusqu'au trait de jauge. La solution obtenue est notée S1.
Calculer la valeur de c1, concentration molaire en soluté apporté de la solution S1.
Facteur de dilution F = 500,0 / 1,00 = 500.
c1 = c0/500 =17,5 / 500 = 3,50 10-2 mol/L.
Etablir le tableau d'avancement.
|
avancement (mol)
|
AH aq
|
+H2O(l)
|
= A-aq
|
+ H3O+aq |
initial
|
0
|
c1V
|
solvant
|
0
|
0
|
en cours
|
x
|
c1V-x |
en grand
|
x
|
x
|
fin ( réaction totale)
|
xmax
|
c1V-xmax |
excès
|
xmax |
xmax |
fin( réaction limitée)
|
xfin |
c1V-xfin |
xfin |
xfin |
Déterminer la valeur de xmax.
c1V-xmax=0 ; xmax=c1V = 0,035 *0,500 = 1,75 10-2 mol.
Les élèves mesurent le pH de la solution S1 et trouvent pH=3,1.
Quelle est la valeur de la concentration finale en ions oxonium [H3O+aq] ? En déduire l'avancement final xf.
[H3O+aq] = 10-pH = 10-3,1 = 7,94 10-4 ~ 7,9 10-4 mol/L.
xf = [H3O+aq] V = 7,94 10-4 *0,5 = 3,97 10-4 ~ 3,9 10-4 mol.
La transformation associée à la réaction de l'acide AH sur l'eau est-elle totale ou limitée ? Justifier.
Taux d'avancement final t1 = xf / xmax = 3,97 10-4 / 1,75 10-2 =2,27 10-2 ~2,3 10-2.
Le taux d'avancement étant inférieur à 1, la réaction est limitée.
Sur leur énoncé de TP, les élèves ont à leur disposition quelques
valeurs du taux d'avancement final de la réaction d'un acide sur l'eau
pour des solutions de même concentration c1.
acide
|
taux d'avancement final
|
acide méthanoïque HCOOH
|
0,072
|
acide éthanoïque CH3-COOH
|
0,023
|
| acide propanoïque CH3-CH2-COOH |
0,018
|
Identifier l'acide.
Il s'agit de l'acide éthanoïque.
|
Accès à la valeur du taux d'avancement final par une mesure conductimétrique.
Dans la seconde partie de la séance, le professeur donne une solution aqueuse S2 de l'acide précédent à la concentration c2 = 5,0 10-3 mol/L. Les élèves procèdent à une mesure conductimétrique sur un volume V2 de cette solution ; ils trouve une conductivité de valeur s2 = 1,07 10-2 S m-1.
On donne les valeurs de conductivités molaires ioniques ( S m2 mol-1 ) : lA- = 4,1 10-3 ; lH3O+ = 35 10-3.
Donner l'expression de s2.
On négligera la contribution de HO-aq.
s2 =lA- [A-aq]2, f + lH3O+ [H3O+aq]2, f ;
La solution étant électriquement neutre : [A-aq]2, f = [H3O+aq]2, f = xf / V2.
s2 =( lA- + lH3O+ ) [H3O+aq]2, f =( lA- + lH3O+ ) xf / V2.
Calculer [H3O+aq]2, f .
[H3O+aq]2, f =s2 /( lA- + lH3O+ ) =1,07 10-2 / ( 4,1 10-3 + 35 10-3) = 2,7 10-1 mol m-3 = 2,7 10-4 mol L-1.
On admet que le taux d'avancement t2 = [H3O+aq]2, f / c2 .
La valeur de t2 est-elle égale ou différente de t1 ? Ce résultat était-il prévisible ? Expliquer.
t2 =2,74 10-4 /5,0 10-3 =5,5 10-2.
t2 diffèrent nettement de t1. Ce résultat étai prévisible car les concentrations c1 et c2 ne sont pas identiques.
c2 est inférieure à c1 : par dilution, un acide faible se rapproche du comportement d'un acide fort.( le taux d'avncement final se rapproche de 1 ).
|
|