Autoprotolyse
de l'eau.
L'équation de la réaction d'autoprotolyse de l'eau est :
A. H3O+
+HO- = 2H2O. Faux.
Réaction entre un acide fort et
une base forte.
B. H2O +H2O =H3O+
+HO-. Vrai.
C. 2H2O + 2e-
= H2 + 2HO-. Faux.
La présence d'électrons indique
une réaction d'oxydoréduction.
La
constante d'équilibre associée à l'équation de la réaction
d'autoprotolyse de l'eau est appelée :
A. Le produit de
solubilité de l'eau. Faux.
B. Le quotient de réaction de l'eau. Faux.
C. Le produit ionique de
l'eau. Vrai.
|
On peut également
interpréter cette constante d'équilibre comme :
A. La constante d'acidité du couple H2O
/ HO-. Vrai.
H2O
+H2O =H3O+ +HO-. KE
= [H3O+]éq [HO-]éq.
B. La constante
d'acidité du couple H3O+
/ H2O.
Faux.
C. La
constante d'acidité du couple H3O+
/ HO-. Faux.
|
On met en
présence 0,6 mole d'acide carboxylique et 0,6 mole d'alcool, puis, sans
intervenir d'aucune façon, on laisse le mélange évoluer à température T
constante. le suivi cinétique de la transformation qui se déroule
a permis de tracer les courbes 1 et 2, représentant l'évolution de
l'avancement en fonction du temps.
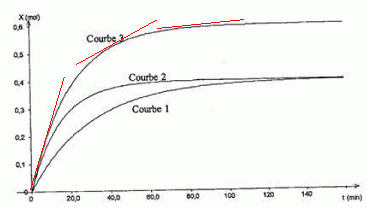
La vitesse volumique de la réaction :
A. est nulle à
l'instant t=0 s. Faux
La vitesse est proportionnelle au
coefficient directeur de la tangente à la courbe à la date
considérée. A t = 0 la tangente n'est pas horizontale..
B.
est
maximale à l'instant t=0 s.
Vrai.
La tangente à t = 0 possède le plus grand
coefficient directeur.
C.
s'exprime en mol min-1. Faux.
en
mol L-1 min-1.
La courbe 3 :
A. peut être obtenue en réalisant la transformation
à une température T3 supérieure à T2. Faux
L'avancement final xf
est égal à xmax =0,6 mol, ce qui indique une
réaction totale. Or
l'estérification peut être rendue totale en utilisant un réactif
en large excès ou en éliminant l'un des produits au fur et à mesure de
sa formation.
B.
peut être obtenue en réalisant la transformation
à une température T3 supérieure à T2 et en présence d'un
catalyseur.
Faux.
C. ne peut pas être
obtenue dans les conditions décrites. Vrai.
L'ester obtenu a pour formule semi-développée :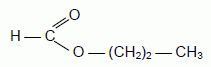 . Son nom est :
. Son nom est :
A.
le propanoate de méthyle. Faux
L'acide carboxylique de départ ne
contient qu'un seul carbone donc méthanoate et l'alcool de départ compte 3 atomes de
carbone donc propyle.
B.
le méthanoate de propanyle.
Faux.
C. le méthanoate de propyle.
Vrai.
A une transformation
chimique est associée la réaction d'équation 2A + B = 2 C + 3D où les
espèces A, B, C et D n'ont pas besaoin d'être précisées. Les mesures
ont permis d'établir le tableau d'avancement suivant :
|
avancement
|
2A
|
+B
|
=2C
|
+3D
|
état
initial
|
0
|
0,40
|
0,30
|
0
|
0
|
état
final
|
xfinal
|
0,30
|
0,25
|
0,10
|
0,15
|
Le taux d'avancement final est :
A.
t = 0,25. Vrai.
t =xfinal / xmax
avec xfinal = 0,10/2 = 0,05 mol.
Si
A est en défaut : 0,40-2xmax = 0 ; xmax = 0,20 ;
si B est en défaut : 0,30-xmax = 0 soit xmax
=0,30 ( retenir laplus petite valeur )
t =0,05 / 0,20 = 0,25.
B. t = 0,50. Faux.
C. t = 0,75. Faux.
Dans
les conditions de l'expérience, la constante d'équilibre K associée à
cette équation est K = 108. Cette valeur :
A.
dépend de la composition initiale du système. Faux.
La constante d'équilibre ne dépend que de
la température.
B. dépend de la
composition initiale du système et de la température. Faux .
C. dépend de la température. Vrai.
Le
taux d'avancement final de la transformation :
A.
dépend de la composition initiale du système et de la constante
d'équilibre. Vrai.
L'avancement
final dépend de K et de la composition initiale du système.
B. ne dépend que de la
composition initiale du système. Faux .
C. ne dépend que de la constante
d'équilibre K. Faux .
On considère un acide noté AH. Lors de la
préparation d'une solution aqueuse, la transformation de cet acide avex
l'eau eqt quasi-totale. On titre cette solution par une solution
aqueuse d'hydroxyde de sodium de concentration molaire en soluté
apporté connue.
l'équation de la réaction de titrage est :
A.
AH + HO-
= H2O + A-. Faux.
Les couples acide
/ base sont : AH / A- et H3O+
/ H2O
( acide fort, entièrement dissocié dans l'eau ).
H3O+ + HO- = 2H2O.
B. H3O+
+ HO-
= 2H2O. Vrai .
C. H3O+
+ A-
= AH +H2O. Faux
Le
suivi pH-métrique de ce titrage a permis d'obtenir la courbe ci dessous
:
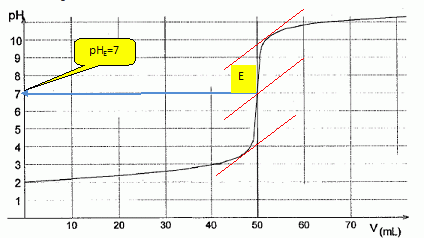
Pour réaliser le suivi colorimétrique de ce titrage :
A. seul
le bleu de bromothymol convient. Vrai.
La zone de irage
de l'indicateur coloré doit contenir le pH du point équivalent, 7 dans
ce cas.
B. Le
bleu de bromothymol et le rouge de crésol conviennent. Faux.
C. Le
bleu de bromothymol, le rouge de crésol et le bleu de bromophénol conviennent. Faux.
indicateur
coloré
|
teinte
acide
|
zone
de virage
|
teinte
basique
|
bleu
de bromophénol
|
jaune
|
3,0 -
4,6
|
bleu
|
bleu
de bromothymol
|
jaune
|
6,0 -
7,6
|
bleu
|
rouge
de crésol
|
jaune
|
7,2 -
8,8
|
rouge
|
|
On réalise le
montage suivant :
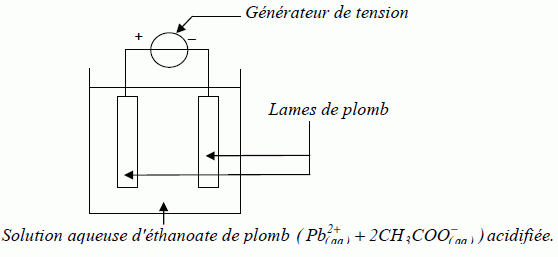
Seul le couple Pb2+/ Pb intervient.
Ce montage permet de réaliser :
A- une pile. Faux.
B- une électrolyse.
Vrai.
Le générateur impose le
sens du courant donc le sens de la transformation chimique.
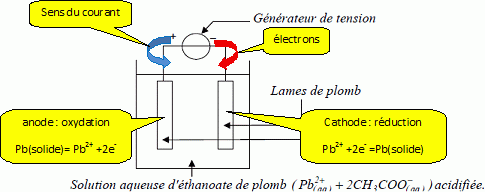
C- une
trnasformation spontanée. Faux.
Une électrolyse est une
transformation forcée qui nécessite un apport d'énergie électrique.
Au bout de quelques minutes on observe :
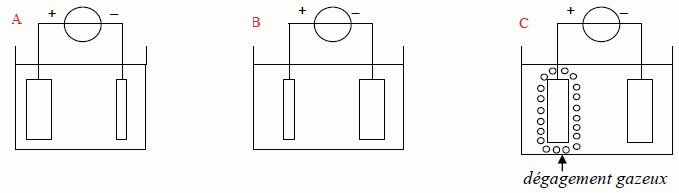
B est vrai
: seul
le couple Pb2+/ Pb intervient.
L'anode s'oxyde, diminue de volume et un dépôt de plomb se forme à la cathode.
On considère une solution aqueuse S1 de nitrate de plomb
(II) ( Pb2+aq + 2NO3-aq ) telle que : [Pb2+aq] = 1,0 10-3
mol/L et une solution aqueuse de chlorure de fer (II) ( Fe2+aq + 2Cl-aq )
telle que : [Fe2+aq]
= 4,0 10-2 mol/L. La constante d'équilibre K associée à la
réaction d'équation : Pb2+aq +Fe(s) = Pb(s) + Fe2+aq vaut 3,0 1010.
Une pile est constituée des deux demi-piles suivantes, reliées par un
pont salin :
- une lame de plomb plongeant dans la solution S1
- une lame de fer plongeant dans la solutuion S2.
On la branche aux bornes d'un conducteur ohmique de résistance R = 100
ohms.
Après une durée de fonctionnement de 30 minutes :
A.
La masse de la lame de fer a augmenté. Faux.
Qr i
= [Fe2+aq]i / [Pb2+aq]i = 4,0 10-2 /1,0 10-3
=40, valeur inférieure à K : évolution dans le sens direct.
Le fer
s'oxyde en ion Fe2+aq : la masse de la lame de fer diminue.
B.
La masse de la
lame de fer a diminué. Vrai.
C.
la valeur de la
résistance R n'a aucune influence sur la variation de masse des lames.
Faux.
Si R augmente l'intensité
du courant diminue ; or la variation de la masse des lames est
proportionnelle à l'intensité.
Dans un becher on plonge
une lame de plomb dans un mélange de 20 mL de la solution S1
et de 20 mL de la solution S2.
A- le système
n'évoluera pas. Vrai.
Le fer est absent
: Pb(s) + Fe2+aq = Pb2+aq +Fe(s) avec K' =
1/ 3,0 1010 = 3,3
10-11.
Qr
i = [Pb2+aq]i / [Fe2+aq]i = 1,0 10-3
/ 4,0
10-2 =0,025,
valeur supérieure à K' : évolution dans le sens inverse.
Le critère d'évolution
spontané prévoit une évolution dans le sens inverse, ce qui est
impossible du fait de l'absence de fer.
B- on observe un dépôt de fer sur la
lame de plomb. Faux.
C- la masse de la lame de plomb va
augmenter. Faux.
|
|
|
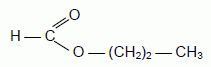 . Son nom est :
. Son nom est :



