Réaction avec le couple Cu2+aq/Cu(s).
Dans un becher, on introduit V1 = 20 mL d'une solution aqueuse de sulfate de cuivre contenant des ions Cu2+aq de concentration C1 =0,10 mol/L, un volume V2 =10 mL de solution de sulfate de zinc contenant les ions Zn2+aq de concentration C2 =0,10 mol/L, une lame de cuivre et une lame de zinc.
Après plusieurs minutes on observe :
- le mélange réactionnel initialement bleu est devenu incolore
- un dépôt métallique rougeatre est apparu sur le zinc
- le mélange réactionnel a subi une légère augmentation de température.
On suppose que la transformation chimique qui se produit
est modélisée par la réaction dont l'équation (1) figure ci-dessous. La
constante d'équilibre de cette réaction a pour valeur K = 2 1037.
Cu2+aq+Zn(s) = Zn2+aq +Cu(s). (1).
Donner l'expression du quotient de réaction Q et calculer sa valeur dans l'état initial.
Q =[Zn2+aq] / [Cu2+aq] ; Qi =[Zn2+aq]i / [Cu2+aq]i =½C2 / (½C1) = 1.
Appliquer
le critère d'évolution spontanée et déterminer le sens d'évolution du
système. Montrer que le sens d'évolution prévu est cohérent avec les
observations expérimentales.
Qi < K, le système évolue dans le sens direct.
Cu2+aq, responsable de la couleur bleue initiale, disparaît : la solution va devenir incolore, (Zn2+aq n'est pas coloré).
On observe la formation de cuivre métal qui se déposera sur le zinc.
|
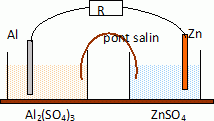
Etude de la pile zinc-aluminium.
On dispose maintenant :
- V1=100 mL d'une solution aqueuse de sulfate de zinc contenant des ions Zn2+aq de concentration c1=0,30 mol/L
- de 100 mL d'une solution aqueuse de sulfate d'aluminium contenant des ions Al3+aq de concentration 0,10 mol/L
- d'une lame de zinc de masse m1 = 3,0 g
- une lame d'aluminium de masse m2 = 3,0 g
- d'un pon salin
- d'un conducteur ohmique de résistance R
- de fils de connexion.
|
On branche un conducteur ohmique aux bones de la pile.
Réaliser le schéma annoté de la pile zinc-aluminium.
L'équation de ,la réaction qui se produit quand la pile débite est :
3Zn2+aq + 2Al(s) = 2Al3+aq +3Zn(s).
Ecrire
l'équation de la réaction électronique qui se produit à l'électrode de
zinc et celle qui se produit à l'électrode d'aluminium.
Réduction de l'ion Zn2+aq à la cathode positive : Zn2+aq + 2e- = Zn(s).
Oxydation de l'aluminium à l'anode négative : Al(s) = Al3+aq +3e-.
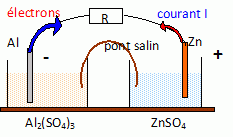
En déduire le sens de circulation des électrons dans le circuit extérieur. Justifier.
Les électrons circulent de l'anode négative d'aluminium vers la cathode positive de zinc.
Indiquer sur le schéma, le sens de circulation des électrons, le sens du courant et la polarité de la pile.
Etude de la pile en fonctionnement.
Déterminer les quantités de matières initiales ( en mol) en ion Zn2+ et en aluminium solide , sachant qu'on utilise la totalité des solutions disponibles pour réaliser la pile.
n(Al) = m2 / M(Al) = 3,0 / 27 = 0,111 ~0,11 mol
n(Zn2+aq) = C1V1 =0,30*0,10 = 0,030 mol.
Compléter le tableau descriptif de l'évolution du système et en déduire xmax.
|
avancement (mol)
|
3Zn2+aq
|
+ 2Al(s) |
= 2Al3+aq |
+3Zn(s) |
Qté d'électrons échangés
(mol)
|
initial
|
0
|
0,03
|
0,11
|
0,010
|
4,6 10-2
|
0
|
en cours
|
x
|
0,03-3x
|
0,11-2x
|
0,010+2x
|
4,6 10-2+3x
|
6x
|
fin
|
xmax. |
0,03-3xmax |
0,11-2xmax |
0,010+2xmax |
4,6 10-2+3xmax |
6xmax |
0,010
|
0
|
0,09
|
0,03
|
7,6 10-2 |
0,060
|
Si Zn2+aq est en défaut : 0,03-3xmax= 0 ; xmax=0,010 mol.
Si Al(s) est en défaut : 0,11-2xmax =0 ; xmax =5,555 10-2 ~5,6 10-2 mol.
On retient la plus petite valeur : xmax =1,0 10-2 mol.
Calculer la quantité maximale Qmax d'électricité que peut débiter cette pile.
Qmax = n F =6xmax F = 0,060 *9,65 104 =5790~5,8 103 C.
Electrolyse d'une solution d'iodure de zinc.
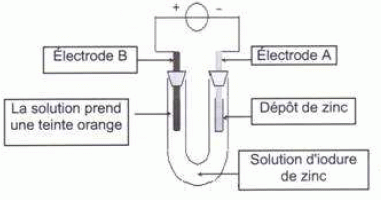
On constate que :
- sur l'électrode A, il se forme un dépôt métallique de zinc
- du côté de l'électrode B, la solution prend une teinte orange.
Quel est le produit formé au niveau de l'électrode B ? Ecrire la demi-équation électronique correspondante.
A l'anode positive ( reliée à la borne + du générateur ), l'ion iodure
s'oxyde en diiode, de couleur jaune brun en solution aqueuse.
2I- aq = I2(aq) + 2e-.
Ecrire l'équation de la réaction électronique modèlisant la transformation sur l'électrode A.
Réduction de l'ion Zn2+aq à la cathode négative ( reliée à la borne négative du générateur ) : Zn2+aq + 2e- = Zn(s).
|
Au cours de l'électrolyse, l'intensité du courant est constante ( I = 500 mA) . Un dépôt de zinc de masse mZn = 1,50 g a été obtenu sur l'électrode A. MZn = 65,4 g/mol.
Calculer la quantité de matière d'électrons ne- en mol qui a circulé pendant l'éledctrolyse.
Quantité de matière de zinc déposé à la cathode : nZn = mZn / MZn = 1,50 / 65,4 =2,2936 10-2 mol
Zn2+aq + 2e- = Zn(s).
ne- = 2 nZn =2*2,2936 10-2 = 4,587 10-2 ~4,59 10-2 mol.
En déduire la quantité d'électricité mise en jeu au cours de l'électrolyse.
Q = ne- F =4,587 10-2 *9,65 104 = 4,427 103 ~4,43 103 C.
Déterminer la durée Dt de l'électrolyse.
Q = I Dt ; Dt = Q / I = 4,427 103 /0,500=8,85 103 s.
Pour
chacune des trois expériences ci-dessus, indiquer si la transformation
mise en jeu est spontannée ou forcée, nécessite de l'énergie ou libère
de l'énergie.
(1) et (2) : les transformations spontannées libèrent de l'énergie.
(3) : l'électrolyse est une transformation forcée qui nécessite un apport d'énergie sous forme électrique.
|


