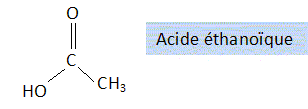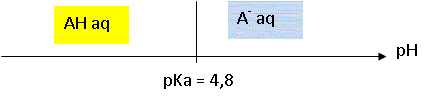On
donne :
| nom |
formule brute |
formule
topologique |
notation
simplifiée |
| géraniol B |
C10H18O |
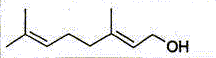 |
C10H17OH |
| éthanoate de
géranyle E |
C12H20O2 |
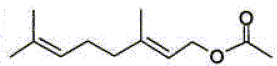 |
C9H15CH2-O-CO-CH3 |
Aide
aux calculs : 130 /166= 0,66 ; 13*196 2,5 103 ;
7,7 / 154 = 0,05.
Afin de préparer l'éthanoate de géranyle, on introduit nHA0
=5,0 10-2 mol d'un acide carboxylique noté AH
avec une masse mB =7,7 g de géraniol dans un
ballon. On aoute quelques gouttes d'une solution concentrée d'acide
sulfurique et quelques grains de pierre ponce. On chauffe à reflux
pendant 55 minutes. Après traitement, on isole une masse mE
du composé E.
Etude
préliminaire et protocole.
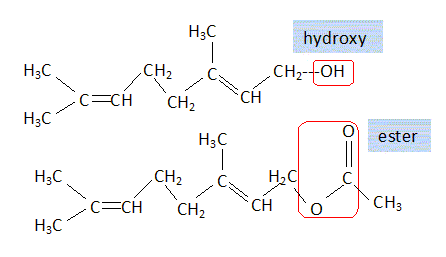
Ecrire les
formule semi-développée du géraniol et de l'éthanoate de géranyle.
Entourer et nommer les groupes caractéristiques présents dans ces
molécules.
Donner
le nom et la formule semi-développée de l'acide carboxylique AH utilisé
pour la synthèse de l'ester.
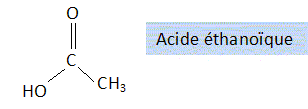
A
l'aide des notations simplifiées écrire l'équation de la réaction de
synthèse de l'éthanoate de géranyle.
C10H17OH
+CH3COOH = C9H15CH2-O-CO-CH3
+H2O.
|
Comment se
nomme ce type de réaction ?
Estérification
Que
peut-on dire de la cinétique de la transformation associée à cette
réaction
?
La transformation est lente et limitée par l'hydrolyse de l'ester.
|
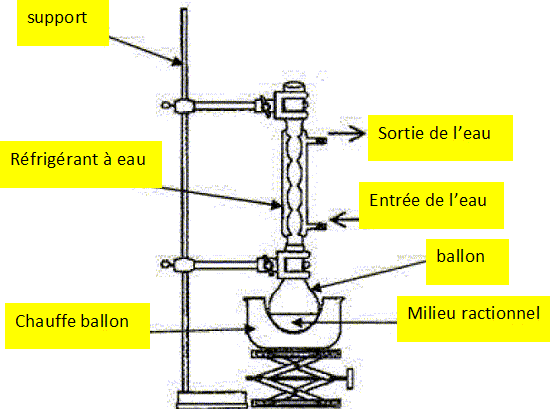
Quel est
l'intérêt d'un montage à reflux ?
Le montage à reflux permet d'accélérer la réaction en travaillant à
température modérée, tout en évitant les pertes de matière ; les
vapeurs se condensent dans le réfrigérant et retombent dans le milieu
réactionnel..
Compléter le montage.
Quel est le rôle de l'acide sulfurique ?
L'acide sulfurique joue le rôle de
catalyseur.
Titrage
de l'acide carboxylique restant lorsque la réaction est terminée.
L'acide carboxylique sera noté AH aq, son couple acide / base associé
AHaq / A-aq.
Ecrire
l'équation de la réaction entre l'acide carboxylique et l'eau.
AH aq + H2O(l) =
A-aq + H3O+aq.
En
déduire l'expression de la constante d'acidité Ka
du couple
AHaq / A-aq.
Ka = [A-aq][H3O+aq]
/ [AH aq]
Donner
l'expression du pKa en fonction de Ka.
pKa
= - log Ka
Sachant
que pKa = 4,8 tracer le diagramme de prédominance du couple
AHaq / A-aq.
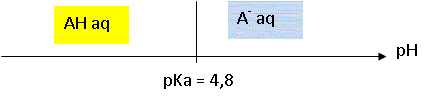
Le
pH d'une solution aqueuse d'acide carboxylique AH vaut 5,9.
Quelle
est l'espèce prédominante du cuple à cette valeur de pH
?
A pH 5,9, valeur supérieure à pKa, la forme base conjuguée A-aq
prédomine.
Une fois la réaction de synthèse terminée, c'est à dire lorsque les
quantités de matière des réactifs et des produits n'évoluent plus, on
titre l'acide carboxylique AH restant dans le mélange réactionnel avec
une solution d'hydroxyde de sodium (Na+aq + HO-aq)
de concentration cS=1,0 mol/L. On réalise un
dosage colorimétrique en utilisant comme indicateur coloré la
phénolphtaléine. Le volume de soude versé à l'équivalence est VEq
= 17,0 mL.
Ecrire
l'équation de la réaction support du titrage.
HO-aq +AH aq = A-aq + H2O(l).
On note nAH la quantité de matière d'acide
carboxylique présent dans le mélang à titrer.
Montrer
que nAH = 1,7 10-2 mol.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques.
nAH = VEq CS
= 17,0 10-3 * 1,0 = 1,7 10-2
mol.
|
Rendement
de la synthèse.
calculer
la quantité de matière initiale nB0 du réactif B.
Masse molaire de B : M = 10*12+18+16 = 154 g/mol ; nB0
= mB / M = 7,7 / 154 = 0,050 mol
Comparer nAH0 et nB0. Conclure.
Ces quantités de matière étant égales, les réactifs sont introduits en
proportions stoechiométriques.
Compléter
littéralement le tableau d'avncement correspondant àla synthèse de E.
|
avancement |
B |
+AH |
=E |
+H2O |
| initial |
0 |
nB0 |
nAH0 |
0 |
0 |
| en
cours |
x |
nB0-x |
nAH0-x |
x |
x |
| à
l'équilibre |
xf |
nB0-xf |
nAH0-xf |
xf |
xf |
Déterminer
l'avancement final de cette réaction.
nAH0-xf
=1,7 10-2 ; 0,050 -xf
=1,7 10-2 ; xf
=3,3
10-2.
Déterminer l'avancement final de cette réaction.
xmax
=5,0
10-2.
Définir
et calculer le taux d'avancement final t de cette
réaction.
t
= xf
/ xmax
=3,3
10-2 / 5,0
10-2 = 3,3 / 5 =0,66.
Après
l'avoir défini, déterminer le rendement de cette synthèse.
Le rendement est égale à la quantité de matière d'ester réellement
obtenue divisée par la quantité de matière maximale théorique d'ester.
Le rendement est égal à 0,66 ( 66 %).
Choisir
en justifiant, parmi les propositions suivantes, celle(s) qui
permettrait ( ent) d'obtenir un meilleur rendement pour la synthèse
del'ester E.
-
utiliser un réactif en excès : l'équilibre est déplacé
dans le sens de la consommation de cet excès, c'est à dire dans le sens
direct, formation de l'ester.
- Augmenter la quantité d'acide sulfurique utilisé.
L'équilibre est plus rapidement atteint, la compositon du milieu, à
l'équilibre, est inchangée.
- Remplacer
l'acide carboxylique par l'anhydride d'acide correspondant.
Il n'y a pas d'eau dans le milieu réatiionnel ; l'hydrolyse de l'ester
est impossible et la réaction d'estérification est totale.
- Ajouter de l'eau distillée au mélange réctionnel.
L'équilibre évolue dans le sens indirect, consommation d'eau et donc
d'ester.
|
|