résumé
de cours
sujets
2000,
01
, 02,
03,
04,
05![]()
fiche
bac
|
|
|
|
Quantité de matière :
|
n : quantité de matière de l'espèce X en mol m : masse de l'espèce X en g M : masse molaire de l'espèce X en g / mol |
masse volumique :
La masse volumique d'un corps est la masse de l'unité de volume de ce corps et se calcule en effectuant le rapport entre sa masse et son volume.
|
r masse volumique du corps X en kg.m-3 m: masse du corps X en kg V: volume du corps X en m3 1000 kg m-3 = 1g cm-3 = 1 g mL-1 |
densité par rapport à l'eau (solide ou liquide)= masse volumique exprimée en g/cm3.
La concentration molaire d'une espèce X en solution est la quantité de matière de l'espèce X contenue dans un litre de solution..
|
n: quantité de matière de l'espèce X en mol V: volume de la solution en L [X]: Concentration de l'espèce X en solution en mol.L-1. 1 mol /L = 1000 mol / m3. |
cas des gaz :
loi des gaz parfaits |
P: pression du gaz en Pa V: volume du gaz en m3 n: quantité de matière de gaz en mol T: température absolue du gaz en K R: constante des gaz parfaits. R=8,32 SI |
|
n: quantité de matière de gaz en mol V: volume du gaz Vm: volume molaire des gaz dans la même unité que V et dans les mêmes conditions de pression et de température |
Une solution électrolytique est obtenue en dissolvant une substance appelée soluté dans un liquide appelé solvant. Le soluté peut être un solide, un liquide ou un gaz. Si le solvant est l'eau la solution obtenue est appelée solution aqueuse.
Une solution électrolytique est une solution contenant des ions. Elle conduit le courant et elle est électriquement neutre.
- Lors de la mise en solution aqueuse du solide ionique, l'eau détruit le cristal. On écrit :
Cu(NO3)2(s) --> Cu2+ (aq) + 2 NO3-(aq).
- Certains liquide comme L'acide sulfurique (H2SO4) donnent des ions lors de leur mise en solution aqueuse. On écrit :
- Le chlorure d'hydrogène HCl est un gaz à pression et température ordinaire qui se dissout très facilement dans l'eau .On écrit :
L'électronégativité d'un élément est la tendance d'un atome de cet élément à attirer le doublet d'une liaison covalente dans laquelle il est engagé.
D'une façon générale,
- L'électronégativité des éléments augmente lorsqu'on se déplace de gauche à droite dans une période (ligne) du tableau périodique des éléments.
- L'électronégativité des éléments augmente lorsqu'on se déplace de bas en haut dans une famille (colonne) du tableau périodique des éléments.
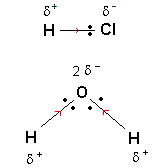
Le barycentre des charges électriques positives se
situe au milieu du segment joignant les deux atomes
d'hydrogène (voir figure). Il apparaît alors
qu'étant donnée la forme de la molécule
d'eau, les barycentres des charges électriques
positives et négatives sont distincts. La
molécule d'eau présente un caractère
polaire.
Les ions positifs (cations) en solution attirent (interaction électrique) les molécules d'eau par leur partie négative. Il en résulte que chaque cation s'entoure d'un certain nombre de molécules d'eau.
Les ions négatifs (anions) en solution attirent les molécules d'eau par leur partie positive. Il en résulte que chaque anion s'entoure d'un certain nombre de molécules d'eau.
Ce phénomène est appelé solvatation des ions. Lorsque le solvant est l'eau la solvatation est appelée hydratation.
|
|
|
|
|
|
La conductance G d'une colonne de liquide est l'inverse de sa résistance R. Elle se mesure en siemens (S). L'appareil de mesure est le conductimètre.
|
G: conductance en siemens (S) I : intensité du courant en ampère (A) U: tension électrique en volt (V) R : résistance en ohm (W) |
- de la cellule de mesure.
- de la nature de l'électrolyte pour une concentration c donnée.
- de la concentration molaire c pour un électrolyte donné.
Aux faibles concentrations (c < 10-2 mol.L-1), la conductance est proportionnelle à la concentration c.
Dans un électrolyte, le courant électrique est un double déplacement d'ions. Les ions positifs (cations) se déplacent dans le sens conventionnel et les ions négatifs (anions) se déplacent en sens inverse.
Relation entre conductance et conductivité : conductivité et conductance sont proportionnelles
|
s : conductivité en S m-1. G = conductance en S k constante de proportionnalité en m-1. |
AB(s) --> A+(aq)+ B-(aq)
|
s : conductivité en S m-1. lA+: conductivité molaire ionique de A+ en S m2mol-1 lB-: conductivité molaire ionique de B- en S m2mol-1 [A+] et [B-] concentration en mol / m3. |
- est d'autant plus grande que les ions sont plus petits.
- est d'autant plus grande que les ions sont moins solvatés (hydratés en solution aqueuse).
- des ions oxonium (H3O+) et hydroxyde (HO-) sont plus fortes que celle des autres ions.
Passage de la conductivité à l'avancement volumique d'une réaction :
exemple :
mise en solution de l'acide éthanoïque dans l'eau
La conductivité de la solution d'acide éthanoïque est dû aux ions produits par la réaction de l'acide éthanoïque avec l'eau, dont l'équation s'écrit : CH3COOH(aq) + H2O(l) = CH3COO-(aq) + H3O+(aq)
Un état d'équilibre est rapidement atteint dans lequel les concentrations des différentes espèces ne varient plus. La conductivité de la solution s'exprime : s = lH3O+[H3O+]éq + l CH3COO-[CH3COO-]éq
On appelle avancement volumique (en mol.L-1) , noté xV, le quotient de l'avancement x de la réaction par le volume V de la solution .
d'après l'équation de la réaction, à l'équilibre, l'avancement volumique xV est égal à la concentration en ions éthanoate et en ions oxonium : xV = [CH3COO-]éq = [H3O+]éq
On en déduit : s = lH3O+xV + l CH3COO-xV soit xV= s / ( lH3O++ l CH3COO-)
Application :
Afin de vérifier la proportionnalité de la conductivité avec la concentration c d'une solution de chlorure de sodium, des élèves proposent le protocole suivant :
- Dans un bécher de 500 mL placé sur un agitateur magnétique verser 50 mL d'une solution de concentration c0 = 2,5 10-2 mol/L = 25 mol m-3 à l'aide d'une fiole jaugée.( la fiole jaugée mesure un volume précis, le becher un volume approximatif )
- Disposer dans le bécher une cellule de conductimétrie et relever la valeur de la conductivité de la solution initiale.
-Verser à l'aide d'une fiole jaugée 50 mLd'eau distillée. Relerver la conductivité de la solution.
L'eau distillée ne contient pratiquement pas d'ion ; l'eau du robinet contient des ions qui contribueraient à la conductivité.
Recommencer plusieurs fois l'opération.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
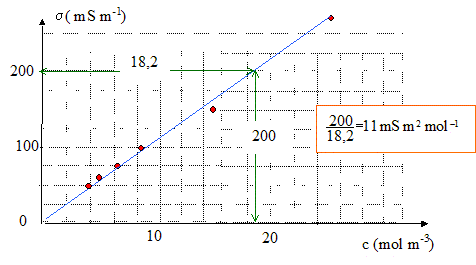
s = 11 c ; s (mS m-1) et c (mol m-3)
On mesure la conductivité d'une solution inconnue de NaCl. On obtient 120 mS m-1.
Sa concentration est : c = 120/11 = 10,9 mol m-3 = 1,09 10-2 mol/L.
Calcul théorique la conductivité d'une solution à c = 5,0 mmol.L = 5 mol m-3. lNa+= 5,0 10-3 S m² mol-1 ;l Cl-= 7,6 10-3 S m² mol-1 ;
s = lNa+[Na+] +l Cl-[Cl-] avec : [Na+] =[Cl-] = c
s =( lNa+ +l Cl-) c = (5+7,6)10-3*5 =6,3 10-2 S m-1 =63 mS m-1.
Ecart relatif avec la valeur mesurée : (63-60) / 60 *100 = 5 % assez faible, donc accord entre calcul et mesure.