résumé
de cours
fiche
bac
|
|
|
|
Une pile électrochimique est un générateur qui transforme de l'énergie chimique issue d'une réaction d'oxydoréduction spontanée en énergie électrique. Une partie est perdue en chaleur (effet Joule).
Les différentes parties de la pile :
- Deux électrodes constituées de matériaux conducteurs (des métaux ou du carbone).
- Une ou plusieurs solutions électrolytiques.
- Un pont salin ou une paroi poreuse.
Rôle du pont salin :
- permettre le passage du courant dans la pile
- assurer la neutralité électrique des solutions.
Polarité de la pile :
Le métal le plus réducteur ( souvent le zinc) constitue la borne négative. Ce dernier s'oxyde et libère des électrons. Brancher un voltmètre aux bornes de la pile. Ces appareils de mesure sont tous les deux munis de deux bornes qui permettent leur branchement. L'une de ces bornes est en général colorée (rouge, jaune ou verte), c'est la borne de mesure. L'autre borne est en général noire, c'est la borne COM.
Le signe de la valeur lue sur l'appareil de mesure correspond à la polarité de l'électrode à laquelle la borne de mesure est reliée .
Fonctionnement :
A la borne négative se produit l'oxydation du réducteur 1
A la borne positive se produit la réduction de l'oxydant 2
Le bilan électrochimique est alors : (pas d'électrons dans ce bilan)
Mouvement des porteurs de charges :
Lorsque la pile débite, les porteurs de charges sont :
-Dans le circuit extérieur à la pile, ce sont des électrons qui circulent dans les fils et dans les conducteurs de la borne négative vers la borne positive (le sens conventionnel du courant est alors de la borne positive vers la borne négative).
-Dans le pont salin et dans les solutions, ce sont des ions qui se déplacent. Le mouvement des ions dans le pont salin est tel que les solutions restent électriquement neutre. Dans la demi-pile qui s'enrichit en cations (électrode négative) le pont salin apporte de anions et dans la demi-pile qui s'appauvrit en cations (électrode positive) le pont salin apporte des cations.
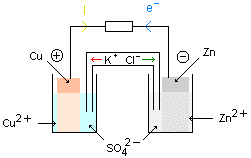
Représentation formelle d'une pile :
La représentation formelle de la pile est obtenue en plaçant la borne négative à gauche et en indiquant les espèces chimiques rencontrées dans la pile. Le pont salin est représenté par une double barre.
Force électromotrice E et résistance interne r.
La caractéristique intensité tension d'une pile est donnée ci-dessous. Son équation est: UPN=E-rI.
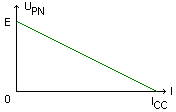
E est appelée force électromotrice (f.e.m) de la pile. Elle se mesure en volt. C'est la tension aux bornes de la pile lorsqu'elle ne débite pas. Pour la mesurer il suffit de brancher un voltmètre aux bornes de la pile lorsqu'elle n'est pas reliée à un circuit. E est alors égale à la valeur absolue de la valeur affichée par le voltmètre.
r est la résistance interne de la pile. Elle se mesure en ohm (W). Elle est numériquement égale à l'opposé du coefficient directeur de la caractéristique intensité-tension.
ICC est le courant de court-circuit.
Quantité d'électricité maximale Qmax ( coulomb) débitée par la pile : capacité en charge de la pile :
Si l'on suppose que l'intensité (ampère) du courant débité est constante: Qmax = I Dtmax.
Dtmax : durée de fonctionnement en seconde.
Soit n la quantité de matière d'électrons fournie par le réductuer pendant Dtmax, alors :
F est appelé faraday et vaut F=96500C.
électrolyse
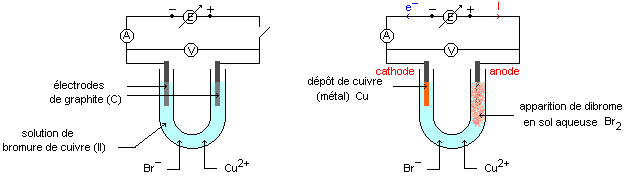
Le symbole du générateur barré d'une flèche représente un générateur de tension continue réglable.
Lorsque la tension appliquée est trop faible (<1,2V) il ne se passe rien. Pour une tension appliquée supérieure à 1,2V, on observe un dépôt de cuivre sur l'électrode négative (cathode) et l'apparition de dibrome en solution au voisinage de l'électrode positive (anode).
A la cathode négative :
Cu2+ + 2e- = Cu , gain d'électrons, c'est une réduction.
A l'anode positive :
2Br- = Br2 + 2e- , perte d'électrons c'est une oxydation.
Bilan : Cu2+ + 2Br- --> Cu + Br2 Ce bilan est l'inverse de celui correspondant à l'évolution spontanée.
Cette transformation forcée est appelée électrolyse.
L'electrode à laquelle se produit une oxydation est appelée anode (électrode par laquelle le courant entre dans l'électrolyseur).
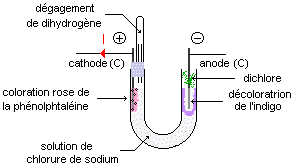
Inventaire des espèces chimiques présentes et pouvant intervenir : le solvant (H2O), les ions sodium (Na+) et les ions chlorure (Cl-) (le carbone (C) des électrodes ne jouent pas de rôle ici, les électrodes sont dites inertes).
Espèce pouvant donner lieu à une oxydation à l'anode :
Les ions chlorure, réducteur du couple Cl2 / Cl- et l'eau, réducteur du couple O2 / H2O.
La décoloration de l'indigo au voisinage de l'anode indique qu'il y a apparition de dichlore:
Espèces pouvant donner lieu à une réduction à la cathode :
Les ions sodium, oxydant du couple Na+ / Na et l'eau, oxydant du couple H2O / H2.
La coloration de la phénolphtaléine au voisinage de la cathode indique qu'il y a apparition d'ions hydroxyde HO-. L'identification du dihydrogène dans le tube à essais se fait grace à l'aboiement en présence d'une flamme.
Quelques applications de l'électrolyse.
- Préparation ou purification de certains métaux: le zinc et l'aluminium sont préparés par électrolyse d'une solution contenant leurs cations ou leurs oxydes. Le cuivre est purifié par électrolyse à anode soluble.
- Préparation de substances non métalliques : le dichlore (ainsi que petite proportion de dihydrogène) et la soude sont préparés par électrolyse d'une saumure (solution très concentrée de chlorure de sodium).
- Dépôts de métaux sur un support métallique : ils se font par électrolyse à anode soluble. L'électrolyte contient les cations du métal à déposer. La cathode est constituée de l'objet (métallisé) à recouvrir. La galvanoplastie a pour but de reproduire un objet, la galvanostégie a pour but de le protéger.
- Les accumulateurs ou les piles rechargeables font intervenir l'électrolyse lors de la phase de recharge.
Il existe ne chimie et en biochimie des réactions spontanées et des réactions forcées qui ne relèvent pas d'un processus électrolytique. Par exemple: la respiration et la photosynthèse chlorophyllienne.
La respiration : c'est un processus biologique dont le déroulement complexe passe par la dégradation d'un nutriment organique. Il apparaît une succession de réactions d'oxydoréduction mettant en jeu le dioxygène. Elle a, entre autres, pour effet de synthétiser la molécule d'ATP, réservoir d'énergie des cellules. Par exemple :
La synthèse chlorophyllienne :
Il s'agit de la synthèse de matière organique avec l'aide de la lumière par les végétaux dits"chlorophylliens".
Il s'agit de la réaction inverse de la précédente (respiration). C'est donc nécessairement une réaction forcée. L'énergie nécessaire est apportée par la lumière.
Electrolyse de l'eau :
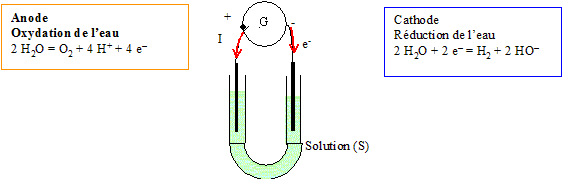
Une électrolyse est une réaction forcée, nécessitant un apport d'énergie sous forme électrique.
Quantité de matière de dioxygène nO2 envoyée par les poumons pendant une heure (on suppose que la température est de 25°C) :
Chaque minute, nos poumons envoient un volume v = 0,30 L de dioxygène vers les tissus (respiration normale), soit 0,30*60 =18 L pendant une heure. Donnée :Vm = 25 L mol-1 à 25°C sous 105 Pa
nO2 = volume de dioxygène (L) / volume molaire (L/mol) = 18/25 = 0,72 mol.
Cette quantité de dioxygène est produite grâce à l'électrolyse de l'eau :
L'oxydation de l'eau s'écrit : 2H2O = O2+4H++4e-
D'après les coeficients stoechiométriques, la quantité de matière d'électrons échangés est 4 fois supérieure à la quantitié de matière de dioxygène.
ne-= 4*0,72 =2,88 mol.
Or la charge d'une mole d'électron est
égale, en valeur absolue, à un faraday soit 96
500 C.
La quantité d'électricité Q mise en jeu
vaut donc : Q= 96500*2,88 =
2,78 105
C.
L'intensité I du courant nécessaire en
supposant qu'elle est constante pendant toute l'heure de
fonctionnement vaut :
I= Q/t = 2,78 105 / 3600 =
77,2 A.
La tension aux bornes du générateur U est de
5,00 V, l'énergie électrique, notée
Eel, consommée pendant une heure vaut
:
Eel = UIDt = 5*77,2*3600 = 1,39 106 J.