|
exercice
1
|
dosage
d'un acide faible par une base
forte
|
|
On neutralise un volume
V=10mL d'une solution S d'acide salicylique
(C7H6O3)
par 12 mL d'une solution de soude de concentration
0,01 molL-1.
vrai ou
faux
- La concentration de la
solution S est égale à 0,012
molL-1.
- Le pKa du couple ac
salicylique / ion salicylate est voisin de
8
masse atomique
molaire g mol-1 : C=12 ; O=16 ;
H=1
|
|
pH
|
2,6
|
2,8
|
3,0
|
3,4
|
4
|
8
|
11
|
|
mL
|
0
|
4
|
6
|
8
|
10
|
12
|
14
|
- La solution S a été obtenue
par dissolution de 828 mg d'acide salicylique
dans 500 mL d'eau.
On dose le même volume d'acide
chlorhydrique de même concentration que S par
la même solution de soude.
L'équivalence est obtenue pour un volume de
soude supérieur à 12 mL
|
|
|
corrigé
|
|
|
à
l'équivalence
la qté de matière d'acide initiale
(mol) est égale a la qté de
matière de soude versée (mol)
CA
VA =CB VB
d'où
CA=12*0.01/10=
1,2 10-2
mol L-1
faux
à la
demi
équivalence de
la réaction de dosage d'un acide faible par
une base forte, le pH est égal au pKa soit
d'après le
tableau
pKa=3
vrai
masse molaire de l'acide salicylique 138 g
mol-1
Qté de
matière 0,828/138=6 10-3 mol dans
0,5 L ;
12,10-3
mol L-1
faux
Dans les deux cas la
Qté de matière d'acide initiale est
la même( peu
importe que l'acide soit entierement ou
partiellement dissocié)
même
volume de soude
|
|
|
|
exercice
2
|
dosage
acide fort base forte
|
|
On dose 20 ml d'une solution d'acide
chlorhydrique par la soude à0,01 molL-1
en présence de BBT. Le virage de
l'indicateur se produit pour un volume de base de 9
mL .
La concentration initiale de l'acide est:
90 mmolL-1 ; 4,5
mmolL-1 ; 4,5
molL-1
|
|
|
corrigé
|
|
|
|
|
Qté de matière d'ion
hydroxyde (mol)
|
0,01*9 10-3
|
9 10-5
|
|
à
l'équivalence qté de
matière d'ion hydronium
(mol)
|
9 10-5
|
|
|
concentration de l'acide
molL-1
|
9 10-5/20
10-3
|
4,5
10-3
|
|
|
|
|
exercice
3
|
degré
d'un vinaigre
|
|
Le vinaigre est une
solution d'acide éthanoique. Son
degré d'acidité représente le
% massique d'acide acétique pur en solution.
pKa =4,8 pour le
couple acide éthanoique / ion
éthanoate.
- réaction entre l'acide
éthanoique et la soude: écrire
l'équation bilan et calculer la constante
Kr.
réaction entre le vinaigre et la
soude: on dilue 10 fois le vinaigre. 20 mL de
cette solution diluée sont dosés par
24 mL de soude à 0,1 mol L-1.
Quel est le degré du vinaigre ?
|
|
|
|
corrigé
|
|
|
|
|
H3CCO2H
+ HO- donnent
H3CCO2- +
H2O
la base la plus forte
HO- réagit naturellement
avec l'acide le plus fort
H3CCO2H
. La constante de cette réaction est
d'autant plus grande que les pKa sont
distincts.
Kr= 10-4,8 / 10-14 =
109,2.
La réaction est
totale.
A
l'équivalence
CaVa=CbVb
Ca=24
10-3*0,1 / 20
10-3=
0,12 mol
L-1.
en tenant compte de la
dilution ,
la concentration du
vinaigre est
1,2 mol
L-1.
masse de vinaigre dans 1
L= masse
molaire
gmol-1 *
concentration
masse d'acide dans 1
L=(2*12+2*16+4)*1,2=
72g
soit 72/1000 *100=7,2% en
masse
degré=7,2
|
H2O
/
HO-
pKa=14
H3CCO2H
/H3CCO2-
4,8
|
|
|
exercice
4
|
dosage
ion hydrogénocarbonate
HCO3- étude de
courbes
|
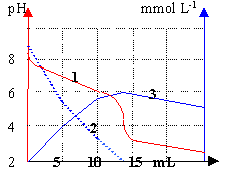
|
Une solution d'ion
hydrogénocarbonate est dosée par une
solution d'acide chlorhydrique à 0,01 mol
L-1. 2
et 3 correspondent aux concentrations
- Commenter chaque courbe.
- Quel est le pKa du couple
CO2/HCO3-
Pourquoi le pH
à l'équivalence est-il
inférieur à 7 ?
|
|
|
|
|
corrigé
|
|
|
|
|
(1)
dosage acide base
pH=f(volume d'acide ajouté)
(2)
évolution de la
concentration en ion HCO3-
au cours du
dosage.
(3)
évolution de la
concentration en CO2
dissout
au cours du
dosage.Au delà
de l'équivalence la qté de gaz
dissout n'augmente plus mais le volume de la
solution augmente, donc la concentration en
CO2
diminue.
A
la demi équivalence d'un dosage acide fort
base faible, le pH est
égal au pKa du couple acide basemis en jeu.
Lecture graphe
(1)
pour V=7 mL acide ajouté.
le pKa est
proche de 6,5
HCO3-
+
H3O+
donnent
CO2
+ 2 H2O
A l'équivalence les
deux réactifs ont disparu; la solution
contient un
acide CO2
dissout
,donc
pH inférieur à
7.
|
|
|
