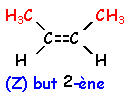
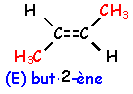
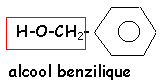
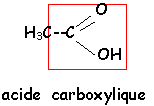voir le Quiz : parfums et savons
|
|
|
|
primaire R-CH2OH secondaire R-CHOH -R' tertiaire RR'COHR"
la liqueur de Fehling bleue donne un solide rouge brique Cu2O
l'ion diammineargent est réduit en argent
le réactif de Schiff devient rose
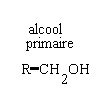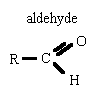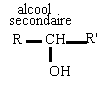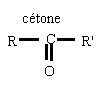
l'oxydation ménagée des alcools conserve le squelette carboné
donne avec la DNPH un solide jaune
|
|
|
|||||||||
|
CnH2n + H2O donne CnH2n+2O
|
||||||||||
|
||||||||||
|
|
||||||||||
|
|
|
|||||||||
|
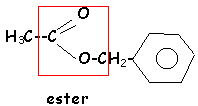
L'hydrolyse de A (C9H10O2 ) conduit à un acide carboxylique C et à un alcool D.
|
||||||||||
|
|
||||||||||
|
||||||||||
|
|
|
|||||||||
|
||||||||||
|
conservation du squelette carboné CH3-CH2-OH +
1/2O2 ---> H2O +
CH3-CHO ethanal
CH3-CH2-OH + 3O2 ---> 3H2O + 2 CO2
CH3-CO-CH3 + O2 ---> 3H2O + 3 C 3 moles de O2 réagissent avec 3 moles propanone en donnant 9 moles d'eau et 9 moles de carbone (9*12=108g). Il reste 1 mole de propanone. |
||||||||||