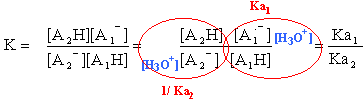|
|
|||||
|
|||||
|
autoprotolyse de l'eau : L'autoprotolyse de l'eau est la réaction entre deux molécules d'eau suivant le bilan : Cette réaction est très peu avancée ([H3O+] est très faible).On remarquera que: [H3O+]=[HO-] la solution étant électriquement neutre. Le produit ionique de l'eau est la constante d'équilibre associée à l'équation d'autoprotolyse de l'eau. Cette constante est notée Ke. Ke=[H3O+] [HO-] Ke s'exprime sans unité alors que les concentrations sont exprimées en mol.L-1. Ke ne dépend que de la température. à 25°C, on a: Ke=1,0.10-14. (Ke croît lorsque la température augmente). échelle usuelle des pH : 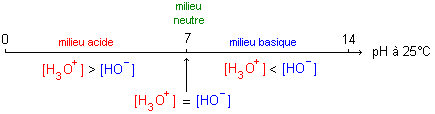 constante d'acidité Ka : pKa = -log Ka La constante d'acidité Ka est la constante d'équilibre associée à l'équation de la réaction d'un acide avec l'eau. Ka = [A-][H3O+]/[AH] cette relation peut s'écrire : pH= pKa + log ([A-]/[AH]). utilité de la constante d'acidité. * Comparer la force relative de deux acides : un acide A1H est plus fort q'un acide A2H, si, à concentrations égales, le taux d'avancement de sa réaction avec l'eau est plus grand que celui de la réaction de l'acide A2H avec l'eau. Soit t1>t2. C'est à dire qu' à concentration égale un acide est d'autant plus fort que son pKa est plus proche de zéro ( que sa constante Ka est grande) * Comparaison des pH des solutions de deux acides de forces différentes : pour des solutions de mêmes concentrations, l'acide le plus fort est celui dont le taux d'avancement final est le plus élevé. Donc c'est celui pour lequel [H3O+] est la plus élevée. [H3O+] et pH varient en sens inverses (pH= -log[H3O+]). Donc l'acide le plus fort est celui pour lequel le pH est le plus faible. * Comparer la force relative de deux bases : une base est d'autant plus forte que la constante d'acidité Ka associée au couple acide/base auquel elle appartient est plus petite ou que le pKa correspondant est plus grand. A concentrations égales, la base la plus forte est celle dont la solution a le pH le plus élevé. Diagramme de prédominance et distribution des espèces acido-basiques : Une espèce A est prédominante par rapport à une espèce B si : [A] > [B] 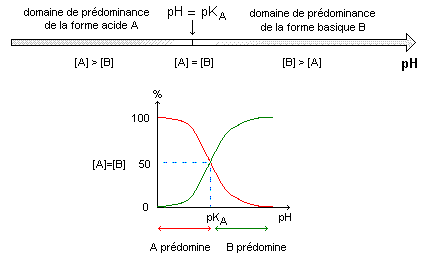 Un indicateur coloré est un couple acide/base conjuguée (on le notera: InH / In- ), dont la forme acide InH et la forme basique In- ont des couleurs différentes en solution. On admet que la solution dans laquelle se trouve l'indicateur a la couleur de la forme acide InH si: [InH]>10[In-]. Soit Ka la constante d'acidité associée à ce couple. La solution aura la couleur de la forme acide si : [In-] / [InH] < 0,1 soit pH < pKa - 1. De même la solution dans laquelle se trouve l'indicateur a la couleur de la forme basique si : [In-] > 10[InH] => pH > pKA +1 La solution prendra une couleur appelée teinte sensible (mélange des couleurs dues à la forme acide et à la forme basique) si: [InH] et [In-] sont du même ordre de grandeur, donc si : pKa-1<pH<pKa+1 défini la zone de virage.
Constante d'équilibre associée à une réaction acido-basique. 1. Equation de la réaction. Une réaction acido-basique est un transfert de proton entre l'acide A1H d'un couple A1H/A1- et la base A2- d'un couple A2H/A2- . L'équation de la réaction peut être considérée comme la somme des deux demi-équations relatives à chaque couple.
La transformation peut être considérée comme totale dans le sens 1 (de la gauche vers la droite) si K>104. La transformation peut être considérée comme totale dans le sens 2 (de la droite vers la gauche) si K<10-4. titrages acido-basiques : Titrer une solution d'acide consiste à déterminer la concentration de l'acide dans cette solution. On utilise pour cela une solution de base de concentration connue appelée solution titrante. Allure générale de la courbe de titrage. ( suivi pHmétrique) 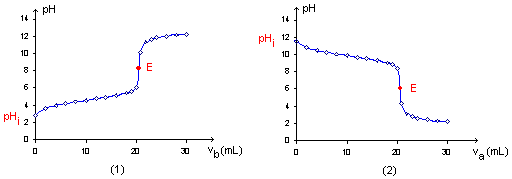 A l'équivalence E, la quantité de matière de l'espèce à titrer et la quantité de matière de l'espèce titrante ont été mélangées et ont réagi dans les proportions stoéchiométriques. Avant l'équivalence la solution titrée est en excès dans le becher ; après l'équivalence la solution titrante est en excès dans le bécher. On écrira à l'équivalence E : Qté de matière d'acide =Qté de matière de base soit CaVa = CbVb. Repérage du point équivalent. La méthode des tangentes parallèles, la méthode de la dérivée qui nécessite l'utilisation d'un ordinateur ( la dérivée passe par un maximum, pic étroit) et l'utilisation d'un indicateur coloré (on parle alors d'un titrage colorimétrique); on choisit un indicateur coloré tel que le point équivalent se situe dans sa zone de virage. pH à l'équivalence : * Titrage d'une solution d'acide faible AH par une solution de base forte représentée par l'ion HO-. L'équation de la réaction est : AH + HO- --> A- + H2O La réaction étant totale, à l'équivalence les espèces AH et HO- ont totalement disparu. La solution ne contient alors que la base A-. Le pH est donc supérieur à 7. *Titrage d'une solution de base faible A- par une solution d'acide fort représentée par l'ion H3O+. L'équation de la réaction est : A- + H3O+ --> AH + H2O La réaction étant totale, à l'équivalence les espèces A- et H3O+ ont totalement disparu. La solution ne contient alors que l'acide AH. Le pH est donc inférieur à 7. *Titrage d'une solution d'acide fort (ou de base forte) par une solution de base forte (ou d'acide fort). L'équation de la réaction est : HO-+ H3O+ --> 2H2O le pH est celui de l'eau, c'est-à-dire 7 à 25°C. |
|||||
|