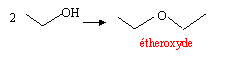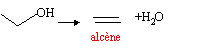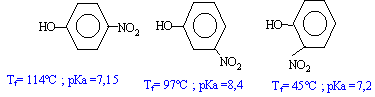|
utiliser les effets stériques et électriques ... moment dipolaire ; interactions ; Van der Waals ; liaison hydrogène ; effet inductif ; effet mésomère ; effet stérique ; contrôle cinétique ; propriétés du solvant ; exercice
|
|||
|
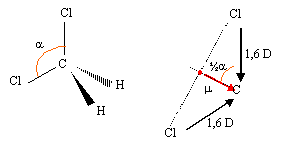
Le moment dipolaire est un vecteur ; il relie le barycentre des atomes électronégatifs de la molécule, au barycentre des atomes électropositifs. exemple : déterminer le moment dipolaire du dichlorométhane, sachant que la liaison CH est apolaire et que la liaison C-Cl est polaire mCCl = 1,6 D; a =110°
m = 2 *1,6 cos (½ a ) = 3,2 cos 55 = 1,84 D. |
|||
|
|
|||
|
l'attraction ou la répulsion entre molécules est due à : - interactions entre molécules polaires (moments permanents) : effet Keesom. - interactions entre moment permanent et un dipole induit : effet Debye - interactions entre moment dipolaire instantané ( du au déplacement des électrons) et moment induit : effet London. application : expliquer l'évolution des températures d'ébullition des halogénures d'hydrogène HX HCl : -84°C ; HBr : -67°C ; HI : -35 °C La polarisabilité des halogènes va croissant dans l'ordre Cl ; Br ; I Les molécules HCl, HBr et HI sont de plus en plus polarisable (effet London) donc une augmentation de la température d'ébullition |
|||
|
forces attractives entre dipoles instantanés ( du au déplacement des électrons); l'énergie de cette liaison est de quelques kJ/mol, cent fois plus faible qu'une liaison de covalence. les constantes physiques (température d'ébullition et de fusion, chaleur latente...) sont d'autant plus élevées que les liaisons de Van der Waals sont fortes. les constantes des alcanes, molécules très peu polaires, sont donc assez basses.
|
|||
|
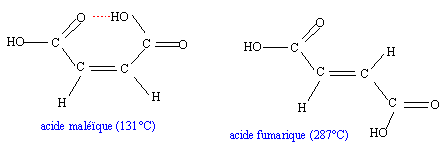
interaction entre un atome d'hydrogène et un atome électronégatif, oxygène, azote... la liaison hydrogène correspond à une énergie de quelques dizaines de kJ/mol, soit dix fois plus que pour une liaison de Van der Waals, mais dix fois moins que pour une liaison covalente.. H2O : la liaison hydrogène assure la cohésion de la glace ; dans le liquide, la liaison hydrogène est responsable de la température d'ébullition élevée. autre exemple : dimérisation des acides carboxyliques
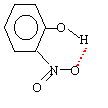
ces liaisons sont responsables d'une augmentation des constantes physiques exemple de liaisons intramoléculaires : celles ci empèchent les associations intermoléculaires et de ce fait font diminuer les constantes physiques par rapport à la même molécule sans liaisons intramoléculaires.
|
|||
|
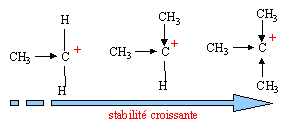
polarisation des liaisons due à la différence d'électronégativité des atomes : H , Mg, Na et Li sont plus électropositifs que le carbone tandis que O, N, les halogènes sont plus électronégatifs. Cet effet se propage très peu dans la chaîne carbonée. stabilisation des carbocations par effet inductif
|
|||
|
effet mésomère possible s'il y a des doublets non liants (N, O, Cl ) et des doublets p conjugués. On observe une délocalisation électronique sur une grande partie de la molécule : il en résulte une stabilité de la molécule d'autant plus grande que la délocalisation est importante. les groupes ( C-OH ; C-NH2 ; C-Br ) sont donneurs( noté +M) ; le groupe -COOH est attracteur (noté -M) l'effet mésomère est plus fort que l'effet inducteur
|
|||
|
encombrement ou gène stérique : il augmente avec la taille des atomes et les ramifications sur la chaine carbonée. il décrit la facilité de l'attaque d'une molécule par une autre molécule.
|
|||
|
Le composé cinétique est celui qui se forme le plus rapidement quand las conditions sont favorables ( température faible, temps de contact court) exemple : déshydratation intermoléculaire d'un alcool en présence d'acide sulfurique, sans chauffer
le contrôle thermodynamique est tout le contraire du contrôle cinétique : c'est le composé le plus stable qui se forme ; sa formation est favorisée par une température élevée, un temps de contact long. exemple : déshydratation intramoléculaire d'un alcool en présence d'acide sulfurique en chauffant.
sous contrôle cinétique, si le produit résulte d'interactions électrostatiques, il y a contrôle de charge. exemple :
|
|||
|
Un solvant polaire possède un moment polaire permanent ( eau, DMSO ) ; l'éther, SO2, le phénol sont peu polaires ; le benzène, les alcanes sont apolaires. Un solvant protique a la capacité d'accepter ou de céder un hydrogène ( un solvant apolaire est aprotique : H peu mobile ) H2O, H2SO4, CH3COOH sont protiques alcanes, etheroxydes sont aprotiques ( très difficile d'arracher H). solubilité : deux espèces non miscibles réagissent mal entre elles, leurs surfaces de contact étant faibles.
|
|||
|
Le moment dipolaire est d'autant plus grand que les barycentres des charges positives et négatives sont plus éloignés l'un de l'autre. Donc le 4-nitrophénol a le moment dipolaire le plus grand et la plus grande température de fusion. Le 2-nitrophénol a le plus petit moment dipolaire ; mais la faible température de fusion s'explique également par des liaisons hydrogènes intramoléculaires au détriment des associations intermoléculaires.
autre conséquence le 2-nitrophénol est le plus soluble dans un milieu peu polaire Dans les composés nitrés, les liaisons hydrogènes sont plus importantes que dans le phénol ; en conséquence l'atome d'hydrogène du phénol est plus mobile, plus acide et les pKa correspondants bien inférieurs à 10. Dans le composé méta, l'encombrement stérique fait que la liaison hydrogène est moins facile à réaliser : d'où un pKa un peu plus grand que 7,2 . retour - menu |