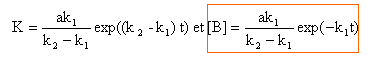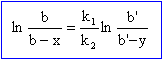|
réactions simples parallèles jumelles
|
||||||||||||||||||
|
A--> B constante de vitesse k1. et B--> A constante de vitesse k2. à l'instant initial t=0 : [A]0 =a ; [B]0 =0
v = d[B] /dt = k1[A] -k2[B] dx/dt = k1(a-x) -k2x dx/dt + (k1+
k2) x = k1a
(1).
solution générale de dx/dt + (k1+ k2) x =0 x = Cte exp (-((k1+ k2) t ) solution particulière de (1) : x = k1a / (k1+ k2) solution générale de (1) : x = Cte exp (-((k1+
k2) t ) + k1a / (k1+
k2)
0 = Cte + k1a / (k1+ k2) solution
: |
||||||||||||||||||
|
|
||||||||||||||||||
|
A--> B constante de vitesse k1. et B--> C constante de vitesse k2. à l'instant initial t=0 : [A]0 =a ; [B]0 =[C]0 =0 vitesse de disparition de [A] : v = -d[A] /dt = k1[A] [A] = Cte exp(-k1t) avec à t = 0 : a = Cte [A] = a
exp(-k1t).
v = d[B] /dt = k1[A] - k2[B] = k1 a exp(-k1t)- k2[B] d[B] /dt + k2[B] =k1 a exp(-k1t) (1) solution générale de d[B] /dt + k2[B] =0 [B] = Cte exp(-k2t) (2) solution particulière de (1) : méthode de la variation de la constante dériver (2) : d[B]/dt = K' exp(-k2t) -Kk2exp(-k2t) repport dans (1) K' exp(-k2t) -Kk2exp(-k2t) + k2K exp(-k2t) = k1 a exp(-k1t) K' exp(-k2t) = k1 a exp(-k1t) K' = k1 a exp((-k1+ k2) t)
[B] = Cte exp(-k2t) + ak1 / ((-k1+ k2) exp(-k1t) .la constante d'intégration est déterminée d'après les conditions initiales: 0 = Cte + k1a / (-k1+ k2) solution
:
|
||||||||||||||||||
|
A+ B --> C constante de vitesse k1. et A+ B --> D constante de vitesse k2. à l'instant initial t=0 : [A]0 =a ; [B]0 = b ; [C]0 =[D]0 =0 écrire les lois de vitesse : v1 = d[C] /dt = k1[A][B] v2 = d[D] /dt = k2[A][B] d[C] /d[D] = k1 / k2 les concentrations de C et de D
sont toujours dans un rapport constant dans le
temps.
A+ B --> C constante de vitesse k1, ordre 1 par rapport à B et A+ B' --> D constante de vitesse k2, ordre 1 par rapport à B' l'ordre partiel par rapport à A est le même dans les deux réactions. à l'instant initial t=0 : [A]0 =a ; [B]0 = b ; [B']0 = b' ; [C]0 =[D]0 =0 à l'instant t : [C] =[x ; D] =y Etablir une relation entre x et y
v1 = d[C] /dt = k1[A]a[B] v2 = d[D] /dt = k2[A]a[B'] v1 = dx/dt = k1(a-x-y)a(b-x) v2 = dy/dt = k2(a-x-y)a(b'-y) rapport de ces deux dernières équations : dx/dy = k1(b-x) / ( k2(b'-y)) dx /(b-x) = k1 / k2 dy / (b'-y) intégrer : -ln(b-x) = - k1 / k2 ln(b'-y) + Cte les conditions initiales permetent de déterminer la constante. -ln(b) = - k1 / k2 ln(b') + Cte Cte = -ln(b) + k1 / k2 ln(b')
|
||||||||||||||||||
|
Les intermédiaires réactionnels restent en quantité pratiquement constante et très faible. d[intermédiaire] / dt =0
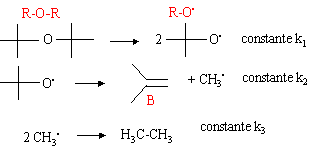
Déterminer la vitesse de la réaction dont le mécanisme est le suivant :
la réaction globale est : R-O-R --> 2 B + H3C-CH3. v = ½ d[B] / dt et d[B] / dt = k2[R-O.] le principe de Bodenstein permet d'écrire : d[R-O.] / dt =0 2k1 [R-O-R] - k2[R-O.] =0 [R-O.] = 2k1 / k2 [R-O-R] v = ½ k2 2k1 / k2 [R-O-R] = k1 [R-O-R].
retour - menu |