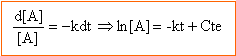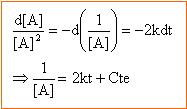|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Soit une réaction du type : A + B --> C. Trois expériences conduisent aux résultats suivants :
La vitesse s'écrit : v = k [A]a [B]b d'après les expériences 1 et 2 : la concentration de A triple alors que celle de B reste constante. dégénérescence de l'ordre : v = k1[A]a avec k1 = k[B]b la vitesse est multipliée par 9 (0,29 = 9 * 0,032 ) alors que la concentration de A triple : a = 2. d'après les expériences 1 et 3 : la concentration de A quadruple en conséquence la vitesse sera multipliée par 16 la concentration de B triple alors que la vitesse est multipliée par 47 environ 16*3 : b = 1. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
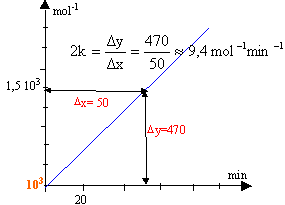
faire l'hypothèse : v = k [NO2]² la loi de vitesse s'écrit : 1/[NO2] =1 /[NO2]0 + k t tracer le graphe de la fonction 1/[NO2] = f (t)
d'où k = 9,4 / 2 = 4,7 mol-1 min -1= 4,7 /60 = 0,156 mol-1 s-1. le graphe est une droite, l'hypothèse est bonne. on déduit du graphe : 1 /[NO2]0 =1000 soit [NO2]0 = 10-3 mol.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
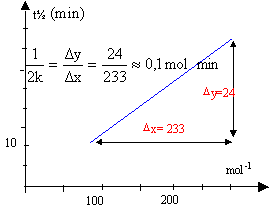
dans l'hypothèse d'un ordre deux : t½ = 1 / (2k[NO2]0) tracer le graphe de la fonction t½ = f (1/[NO2]0)
d'où k = 5 mol-1 min -1. le graphe étant une droite l'hypothèse est vérifiée.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
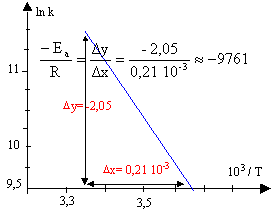
loi d'Arrhénius : 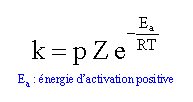
ln k = ln (pZ) -Ea / (RT) tracer le graphe de la fonction : ln k = f(1/T)
Ea = 9761 *8,31 = 81,1 kJ/mol.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On introduit 10 -2 mole de soude et 10 -2 mole d' un ester soluble dans 1 litre d' eau à 27° C.
R-COOR1 + HO- = R-COO- + R1-OH
dx/ dt = k(0,01-x)² soit dx / (0,01-x)² = kdt par intégration kt = 1/(0,01-x) + Cte à t=0, x=0 d'où Cte = -1/0,01 kt = 1/(0,01-x) -1/0,01 au bout de 2 heures : t= 2 ; 0,01-x = 0,01*0,25 =2,5 10 -3 mol k= ½(400-100 ) = 150 mol L-1heure -1. à t½ la moitié de l'ester a réagi soit x = 0,005 mol t½ = 1 / (ka) avec a = 0,01 mol t½ =0,66 heure = 40 minutes. k= A exp ( -E/ (RT) ou ln k = ln A -E/(RT) ln k1= ln A-E/(300R) ln k2 =ln (4k1)= ln A - E/(400R) ln 4 + ln k1 = lnA-E/(400 R) ln 4 +lnA-E/(300R) = lnA-E/(400 R) ln 4= E/ R( 1/300 -1/400) = 10-4 E E = 1,4 10 4 J . à 127°C, la constante de vitesse quadruple donc t½ est divisé par 4 . dans le cas où les quantités de matière initiales des réactifs sont différentes a mol d'ester et b mol d'ion hydroxyde ( en excès) dx/dt = k (a-x)(b-x) dx / ((a-x)(b-x)) = kdt 1/(b-a)[dx/(a-x) - dx/(b-x)}=kdt par intégration : 1/(b-a) ln[(b-x)/(a-x)]+Cte = kt condition initiale : à t=0 , x=0 d'où la constante d'intégration Cte = - 1/(b-a) ln(a/b) 1/(b-a) ln[a(b-x)/((a-x)b)] = kt
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Toutes les études sont faites à un pH, à un volume et à une température que l’on peut considérer comme constants. Dans un souci de simplification, on écrira l'équation de la réaction : Cr3+ + EDTA --> CrIII-EDTA où EDTA désigne toutes les formes acido-basiques de l’EDTA non complexé et CrIII-EDTA désigne le complexe que l’on notera par la suite X. La réaction est totale, elle est d’ordre partiel 1 par rapport aux ions Cr3+ et d’ordre partiel 1 par rapport à l’EDTA. On suit le déroulement de la réaction par la mesure de l'absorbance A d’un échantillon de la solution prélevé à différentes dates t, à la longueur d’onde l = 540 nm. A cette longueur d’onde, seuls Cr3+ et le complexe X absorbent. On notera e1 le coefficient d’absorbance molaire de Cr3+ et e1 le coefficient d’absorbance molaire de X. On mélange 76,0 mL de solution d’EDTA à 0,100 mol.L-1 amenée préalablement à pH = 5,1 avec 4,0 mL d’une solution d’ions Cr3+ à 0,060 mol.L-1. Les résultats sont :
corrigé v=k[Cr3+][EDTA] concentration (mol/L) = Qté de matière (mol)/ volume de la solution (L) Qté de matière (mol) = concentration (mol/L) * volume (L) [Cr3+]0= C0=0,06*4/80=0,003 mol/L [EDTA]0=0,1*76/80=0,095 mol/L en grand excès, donc a peu près constante donc v = kobs [Cr3+] ;
dx / ([Cr3+]0- 12,5 x) = - kobs dt par intégration : ln ([Cr3+]/Co)= -kobs t ln ([Cr3+]0- 12,5 x) = -kobs t + Cte. à t=0 , x= 0 d'où la constante : Cte = ln ([Cr3+]0) ln ([Cr3+]0- 12,5 x) = -kobs t + ln ([Cr3+]0) ln ([Cr3+]0- 12,5 x) - ln ([Cr3+]0) = -kobs t ln (([Cr3+]0- 12,5 x)/[Cr3+]0) = -kobs t ln (([Cr3+]/[Cr3+]0) = -kobs t . loi de Beer-Lambert : A0=e1 L [Cr3+]0 Ainf = e2 [X]inf L avec [X]inf = [Cr3+]0 soit Ainf = e2 L [Cr3+]0 Ainf-A0= [Cr3+]0 L(e2-e1) At= e1 [Cr3+]L+e2[X]L Ainf -At =e2 L [Cr3+]0 - e1 [Cr3+]L+e2[X]L = e2 L([Cr3+]0- [X])-e1 [Cr3+]L Or[Cr3+]0- [X]=[Cr3+]t Ainf -At =e2 L[Cr3+]t-e1 [Cr3+]tL = [Cr3+]t(e2-e1)L (Ainf - A0)/(Ainf - At) =[Cr3+]0 L(e2-e1) / ( [Cr3+]t(e2-e1)L )=[Cr3+]0/ [Cr3+]t ln((Ainf - A0)/(Ainf - At))= ln ([Cr3+]0/ [Cr3+]t)= kobs t (Ainf - A0) = 0,587.
écart relatif = (8,12-7,78)/8 = 0,04 ( 4%) kobs est constant à 4 % près et en conséquence les résultats expérimentaux confirment l’ordre 1 par rapport à Cr3+.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||