|
mélange idéal ; écarts à la loi de Raoult ; petit lexique ; Gibbs-Konovalov ; placer les espèces dans les différents domaines; tracer le diagramme binaire à partir de la courbe d'analyse thermique ; comment tracer la courbe d'analyse thermique ? ; surfusion des solides ; th. des moments chimiques ;
|
||||||||||||||||||
|
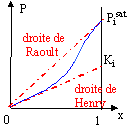
Microscopiquement la solution se comporte comme un liquide pur : les interactions entre molécules différentes et molécules identiques sont égales. Il faut pour cela que les molécules soient assez semblables ( exemple O2 et N2). La loi de Raoult permet de savoir si un mélange est idéal : Pi = xi Pisat (T). la pression partielle Pi du composé i au dessus d'une solution idéale est proportionnelle à sa fraction molaire xi dans la solution. Pisat (T) pression de vapeur saturante du composé i à la température de l'expérience. Si la solution n'est pas idéale, la loi de raoult devient une loi limite quand x-->1 ( quand on se rapproche du constituant pur)
La loi de Henry traduit un comportement limite pour les solutions infiniment diluées. |
||||||||||||||||||
|
|
||||||||||||||||||
|
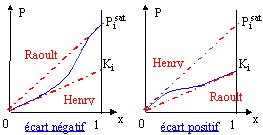
Pour les solutions réelles, on parle d'écart à la loi de Raoult: écart positif si Pi > Pi idéale ( interactions entre molécules différentes plus faibles qu'entre molécules identiques). Dans le cas contraire on parle d'écart négatif.
Comment tracer les diagrammes binaires ? Ils sont tracés pour une température constante. diagramme en fuseau ou diagramme isotherme idéal pour des liquides totalement miscibles.
diagramme isotherme non-idéal (ou diagramme à extrémum) pour des liquides totalement miscibles.
|
||||||||||||||||||
|
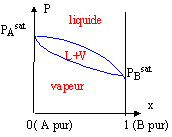
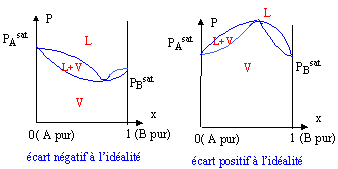
diagramme liquide vapeur : courbe d'ébullition : l'ébullition est le moment où apparaît la première bulle de vapeur. Cette courbe est la séparation entre le liquide et le mélange liquide -vapeur. courbe de rosée : c'est la courbe qui sépare la vapeur du mélange liquide-vapeur. La rosée est le moment où apparaît la première goutte d'eau. azéotrope : c'est le nom des extremums ( minimum ou maximum) dans les diagrammes ci-dessus. L'azéotrope est une solution ayant les apparences d'un corps pur mais dont la composition varie avec la température ou la pression
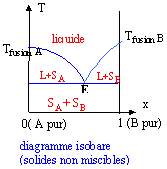
diagramme solide liquide :
solidus : c'est la séparation du solide et du mélange solide liquide. ( apparition de la première goutte de liquide) liquidus : c'est la séparation du liquide et du mélange liquide-solide. ( apparition du premier grain de solide) eutectique : c'est l'équivalent de l'azéotrope minimum.(il n'y a pas de maximum dans le cas des mélanges liquide solide).
|
||||||||||||||||||
|
Dans un diagramme isotherme ou isobare si la courbe d'ébullition présente un extremum, alors la courbe de rosée présente le même type d'extremum au même point. Au point d'extremum de la pression de vapeur ou de la température d'ébullition, les compositions du liquide et de la cvapeur sont identiques.
|
||||||||||||||||||
|
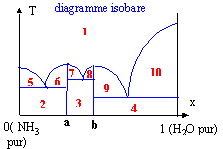
Il existe deux types de diagrammes: les diagrammes isobares ( la température varie); quand on monte on rencontre successivement solide, liquide puis vapeur. et les diagrammes isothermes ( la pression varie) ; c'est exactement l'inverse, on rencontre successivement solide, liquide et puis gaz en descendant. Le composé A ( x=1) se situe à droite et le composé b (x=0) se situe à gauche. exemple du diagramme isobare eau ammoniac : il existe deux composés bien définis noté a = 2NH3, H2O et b= NH3, H2O.
1 : liquide amoniac et eau miscibles en toutes proportions 2 : NH3 (s) et a(s) :; 3 : a(s) et b(s) ; 4: b(s) et eau (s) 5 : NH3 (s) et liquide (1) ; 6 : a(s) et liquide (1) ; 7 : a(s) et liquide 1 ; 8 : b(s) et liquide (1) ; 9 : b (s) et liquide (1) ; 10 : eau (s) et liquide (1)
|
||||||||||||||||||
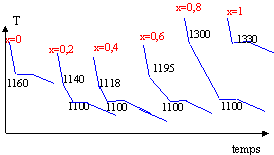
Le nombre de points permet simplement de construire l'allure du diagramme binaire. Les caractéristiques de ces courbes c'est les ruptures de pente.
|
||||||||||||||||||
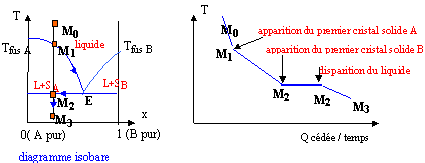
Prendre un point M0 dans le liquide et refroidir lentement le système. Le premier cristal de A apparaît ( point M1). La composition du liquide suit la courbe M1E ; la phase liquide s'appauvrit en A. En E apparaissent les premiers cristaux de B. Au point M2 il y a disparition de la dernière goutte de liquide. La température diminue encore et on arrive à M3.
|
||||||||||||||||||
|
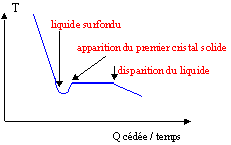
Dans de nombreux cas lors du changement d'état liquide --> solide, un phénomène appelé surfusion apparaît : il s'agit d'un problème de cinétique qui fait que le liquide existe encore sous la température de fusion, avant que le solide n'apparaisse et ne revienne à la température de fusion. La courbe d'analyse thermique se présente alors ainsi :
|
||||||||||||||||||
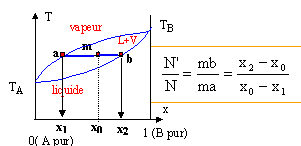
Le point m à l'intérieur du fuseau indique que nous sommes en présence du mélange liquide + vapeur ; il nous renseigne aussi sur les proportions respectives du liquide et de la vapeur. Le mélange comporte N mol de liquide et N' mol de vapeur.
|
||||||||||||||||||
|
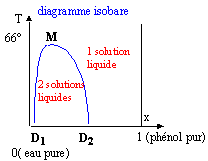
Certains mélanges liquides ne sont miscibles que dans un domaine restreint de composition qui est fonction de la température. Ainsi à 20°C si on ajoute progressivement du phénol à de l'eau, à partir d'une certaine masse de phénol ajoutée, le système se sépare en deux phases distinctes : c'est le phénomène de démixtion. La couche inférieure est une solution saturée d'eau dans le phénol ; la couche supérieure correspond à une solution saturée de phénol dans l'eau. En faisant varier la température de l'expérience on obtient les deux courbes de solubilité réciproques D1M (solubilité du phénol dans l'eau) et D2M ( solubilité de l'eau dans le phénol).
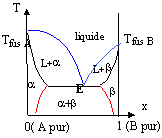
en bleu : liquidus ; en noir : solidus ; en rouge : courbes de démixtion. solution solide de substitution : les deux solides cristallisent dans le même type de réseau cristallin avec des paramètres de mailles voisins; l'un des solides peut prendre la place de l'autre dans le réseau. A et B totalement miscibles à l'état solide si il n'y a pas de courbes de démixtion en dessous de celle du solidus. A et B partiellement miscibles à l'état solide alors présence de courbes de démixtion partie notée a : solution solide de B dans A ( B et A totalement miscibles) ou zone de solubilité parfaite de B dans A partie notée b: solution de A dans B ou zone de solubilité parfaite de A dans B partie notée a+b : deux solutions solides
retour - menu |